
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительное титрованиеСодержание книги
Поиск на нашем сайте
Н. В. Степанова
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ (РЕДОКСИМЕТРИЯ)
Методические рекомендации по выполнению лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 18.05.01 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 19.03.01 «Биотехнология» и 19.03.02 «Продукты питания из растительного сырья» всех форм обучения
Бийск Издательство Алтайского государственного технического университета им. И.И.Ползунова
УДК 543. 06(075.8) Рецензент: профессор, кандидат химических наук Ю.В. Мороженко Работа подготовлена на кафедре общей химии и экспертизы товаров Степанова, Н.В. Окислительно-восстановительное титрование (редоксиметрия): методические рекомендации по выполнению лабораторной работы по курсу «Аналитическая химия» для студентов специальности 18.05.02 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 19.03.01 «Биотехнология» и 19.03.02 «Продукты питания из растительного сырья» всех форм обучения / Н.В. Степанова; Алт. гос. техн. ун-т БТИ. – Бийск: Изд-во Алт. гос. техн. ун-та, 2014. –22 с. В методических рекомендациях приведены теоретические сведения по теме данной лабораторной работы. Изложена методика проведения экспериментов. Для закрепления материала предусмотрены контрольные вопросы и задачи. Работа выполнена в рамках современных требований СМК к изложению и качеству учебно-методического материала. Методические рекомендации составлены в соответствии с государственными стандартами высшего образования указанной специальности и направлений.
УДК 543. 06(075.8)
Рассмотрены и одобрены на заседании кафедры общей химии и экспертизы товаров Протокол № 5 от 03.06. 2014 г
Содержание
ВВЕДЕНИЕ
Изучение дисциплины «Аналитическая химия» должно способствовать решению следующих задач: - освоению студентами качественных и количественных химических методов анализа для оценки качества и идентификации органических, неорганических веществ, биологически активных веществ и лекарственных препаратов; - изучению теоретических основ методов анализа сырья, готовой продукции и объектов окружающей среды; - получению студентами прочных практических навыков в области физико-химических методов анализа, применяемых при аналитическом контроле производства заводскими лабораториями предприятий важнейших отраслей промышленности и в лабораториях НИИ. Изучение дисциплины «Аналитическая химия» должно способствовать формированию у студентов следующих профессиональных компетенций по видам деятельности: Направление подготовки 19.03.01 «Биотехнология» - стремиться к саморазвитию, повышению своей квалификации и мастерства, приобретать новые знания в области техники и технологии, математики, естественных, гуманитарных, социальных и экономических наук (ОК-7); - быть способным и готовым использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1); - использовать знания о современной физической картине мира, пространственно-временных закономерностях, строении вещества для понимания окружающего мира и явлений природы (ПК-2);
- уметь работать с научно-технической информацией, уметь использовать отечественный и зарубежный опыт в профессиональной деятельности, систематизировать и обобщать информацию по использованию ресурсов производства (ПК-6); - владеть планированием эксперимента, обработкой и анализом полученных результатов (ПК-8). Направление подготовки 19.03.02 «Продукты питания из растительного сырья»
- использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ОК-10); - обладать способностью определять и анализировать свойства сырья и полуфабрикатов, влияющие на оптимизацию технологического процесса и качество готовой продукции, ресурсосбережение, эффективность и надежность процессов производства (ПК-4). Специализация 18.05.01 «Химическая технология энергонасыщенных материалов и изделий» - обладать пониманием экологических и технологических последствий своей профессиональной деятельности, роли охраны окружающей среды и рационального природопользования для сохранения и развития цивилизации (ОК-10); - обладать способностью применять современные методы исследования, проводить стандартные и сертифицированные испытания материалов, изделий и технологических процессов (ПК-21); - обладать способностью планировать и проводить необходимый эксперимент, корректно обрабатывать его результаты и анализировать полученные результаты (ПК-22); - обладать способностью изучать научно-техническую информацию, отечественный и зарубежный опыт по тематике исследований (ПК-23).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Влияние различных условий на скорость окислительно-восстановительных реакций
На скорость реакций окисления-восстановления влияют следующие факторы: 1. Концентрация. Скорость редокс-реакций тем больше, чем больше концентрация реагирующих веществ (до определенных пределов).
а Ок1 + b Восст1→ с Восст2 + d Ок2 2. Температура. Повышение температуры эндотермических реакций на каждые 10 градусов увеличивает скорость реакции в 2–3 раза (правило Вант-Гоффа). 3. рН раствора. Концентрация Н+– или ОН-–ионов изменяет скорость реакций, идущих с их участием. 4. Присутствие катализатора или ингибитора. Катализатором может быть постороннее вещество или продукт реакции (автокаталитические реакции). Например, взаимодействие перманганата калия с оксалатом натрия начинает протекать через значительный промежуток времени, несмотря на большую разность потенциалов.
1.3 Характеристика методовредоксиметрии Название методов редоксиметрии обычно происходит от названия используемых титрованных растворов рабочих веществ (РВ). В настоящее время разработано более 50-ти методов окислительно-восстановительного титрования. Наиболее широкое применение получили следующие виды редокс-титрования, представленные в табл. 1. Перманганатометрия В перманганатометрическом титровании в качестве рабочего вещества используют перманганат калия. Растворы его готовят, как правило, по приблизительной навеске, затем выдерживают 7–10 дней, отфильтровывают выделившийся MnO2 и устанавливают точную концентрацию титрованием. Титруют без индикатора: в конечной точке титрования от малейшего избытка KMnO4 раствор окрашивается в бледн-розовый цвет. Раствор KMnO4 можно готовить из фиксанала, используя бидистиллированную воду.
В качестве установочных веществ используют щавелевую кислоту Н2С2О4 · 2Н2О и ее соли Na2C2O4, (NH4)2C2O4 и другие. Во-первых, титрование чаще всего ведут в кислой среде, так как окислительная способность перманганата калия в кислой среде выше, чем в щелочной. Во-вторых, легче фиксировать точку эквивалентности (из бесцветного раствора переходит в бледно-розовый). В нейтральной же и слабощелочной средах образуется бурый осадок MnO2 и на его фоне труднее фиксировать точку эквивалентности. В-третьих, ионы Mn2+ играют роль катализатора в данной реакции и увеличивают скорость ее протекания. Для подкисления титруемых растворов чаще всего применяют серную кислоту, так как азотная кислота, являясь окислителем, может способствовать возникновению нежелательных побочных процессов, а соляная кислота может окисляться перманганатом калия или промежуточными оксидами, которые образуются в ходе основной реакции.
Таблица1─ Классификация методов редоксиметрии
Точку эквивалентности в перманганатометрии определяют безиндикаторным методом, но в случае титрования очень разбавленными растворами перманганата калия применяют редокс-индикаторы: чаще дифениламин, ферроин. По методу перманганатометрии можно количественно определять окислители, восстановители и вещества, способные взаимодействовать с окислителем или восстановителем. Перманганатометрию применяют и для анализа легко окисляющихся органических соединений (альдегидов, кетонов, спиртов, карбоновых кислот: щавелевой, винной, лимонной, яблочной, а также гидразогрупп). В пищевой промышленности перманганатометрию можно исползовать для определения содержания сахара в пищевых продуктах и сырье, окисляемости воды, содержания нитритов в колбасных изделиях.
Иодометрия и иодиметрия В основе данных методов используется реакция:
Восстановители, имеющие редокс-потенциал меньше +0,534 В, способны окисляться свободным иодом. Ионы I– способны восстанавливать окислители, имеющие редокс–потенциал больше +0,534 В. Восстановители определяют прямым или обратным (слабые восстановители) титрованием раствором иода. Слабые восстановители можно определять и прямым титрованием, но для этого предварительно необходимо понизить потенциал их систем введением в раствор соответствующих комплексообразователей.
Для определения окислителей используют рабочий раствор Na2S2O3 и способ замещения.
K2Cr2O7 + 7H2SO4 + 6KI → K2SO4 + Cr2(SO4)3 + 3I2 + 7H2O
I2 + 2Na2S2O3 → 2NaI + Na2S4O6
Окислитель вытесняет из KI эквивалентное количество заместителя I2, который затем оттитровывают рабочим раствором тиосульфата натрия Na2S2O3. Метод титрования раствором I2 называют иодиметрией, заместительное титрование – иодометрией. Прямая реакция восстановления иода идет быстро, но обратная реакция окисления иодид–ионов протекает медленно. I– – слабый восстановитель, поэтому перед титрованием анализируемую пробу с добавленным к ней КI выдерживают 5 минут в темноте. В кислой среде КI переходит в НI, и на свету НI разлагается до I2, что вызывает повышенный расход раствора титранта. Обычно используют избыток KI, который необходим для лучшего растворения выделившегося I2, предупреждения его улетучивания и увеличения скорости реакции. Растворы Na2S2O3 готовят по приблизительной навеске с добавлением Na2СO3, выдерживают 7–10 дней, отфильтровывают выделившуюся серу и устанавливают точную концентрацию титрова-
нием. Карбонат натрия добавляют для стабилизации тиосульфата, который легко взаимодействует с кислородом воздуха и диоксидом углерода. В качестве установочного вещества для Na2S2O3 используют дихромат калия, раствор которого готовят из фиксанала или по точной навеске. Необходимо строгое соблюдение рН и температуры раствора. В качестве индикатора используют специфический индикатор – крахмал, который с раствором йода образует характерную синюю окраску, связанную с образованием адсорбированного комплекса. Растворы I2 в иодометрии готовят по точной или приблизительной навеске или из фиксанала. Иод легко очищается от примесей сублимацией. Следует учитывать, что иод летуч и взвешивание его надо проводить в бюксах (стеклянные стаканчики с пришлифованной пробкой). Ввиду малой растворимости йода, растворы его готовят с добавлением KI. При этом образуются растворимые в воде комплексы [I3]- или [I5]-, например:
I- + I2→ [I3]-.
Если необходимо, точную концетрацию раствора йода устанавливают с помощью титрованного раствора стандартного вещества оксида мышьяка As3O3 или тиосульфата натрия Na2S2O3. В пищевой промышленности методом иодометрии определяют витамин С в овощах и фруктах, остаточный хлор в хозяйственно-питьевой воде после ее хлорирования, медь в кондитерских изделиях, сернистую кислоту в производстве сырого кукурузного крахмала, содержание хлеба в котлетном фарше, олова в консервах. Дихроматометрия В методе дихроматометрии в качестве рабочего вещества используют дихромат калия (K2Cr2O7). K2Cr2O7 – вещество стандартное и растворы его готовят по точной навеске или из фиксанала. Для фиксирования точки эквивалентности используют редокс-индикаторы – дифениламин, дифениламиносульфокислоту, дифенилантраниловую кислоту. Прямым титрованием определяют восстановители.
Броматоматрия В броматометрии в качестве рабочего вещества используют бромат калия KBrO3. Окислительно-восстановительный потенциал редокс -пары Е0 (BrO3–+ +6Н+/ Br –+3Н2О) равен 1,44 В. Несмотря на высокое значение стандартного редокс–потенциала скорость реакции окисления броматом недостаточно высока, и титрование ведут в сильно кислой среде при нагревании. Раствор KBrO3 может быть приготовлен по точной навеске соли, перекристаллизованной и высушенной при температуре 150–180 °С. Если же раствор готовят по приблизительной навеске, то концентрацию устанавливают йодометрически: добавляют КI и НCl и выделившийся в эквивалентном количестве йод титруют в присутствии крахмала раствором тиосульфата натрия до обесцвечивания раствора.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Лабораторная работа № 1 «Определение ионов железа (II) в соли Мора перманганатометрическим методом (6 часов) Цель работы: освоить основные операции окислительно-восстановительного метода титрования и определить содержание ионов железа (II) в растворе его соли. Порядок проведения работы Перед проведением анализа проводят стандартизацию раствора перманганата калия по щавелевой кислоте. Содержание отчета о работе Отчет должен содержать следующие разделы: - цель работы; - основные теоретические положения, используемые в данной работе; - расчетные формулы, уравнения и расчеты по ним; - выводы о проделанной работе; - решение задач. Необходимые реактивы 1. Перманганат калия» 0,1М раствор. 2. Щавелевая кислота, первичный стандарт. 3. Серная кислота 2н раствор.
2.2 Лабораторная работа № 2 «Определение ионов меди (II) в растворе её соли иодометрическим методом (6 часов) Цель работ: знакомство с иодометрическим методам анализа и определение содержания ионов меди (II) в растворе её соли. Порядок проведения работы Содержание отчета о работе Отчет должен содержать следующие разделы: - цель работы;
- основные теоретические положения, используемые в данной работе; - расчетные формулы, уравнения и расчеты по ним; - выводы о проделанной работе; - решение задач. 2.2.5 Необходимые реактивы: 1.Тиосульфат натрия» 0,1М раствор. 2. Раствор иода, первичный стандарт. 3. Иодид калия, свежеприготовленный 20%-ный раствор или кристаллический. 4. Крахмал, свежеприготовленный 1%-ный раствор.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие реакции используют в методах редоксиметрии? 2. Какие вещества можно определять методом редоксиметрии? 3. Какие применяют способы фиксирования точки эквивалентности? 4. Объясните механизм действия редокс-индикаторов. Как их выбирают для титрования? 5. Какие факторы и как они влияют на скорость реакций окисления-восстановления? 6. Как классифицируют методы окисления-восстановления? 7. В чем сущность перманганатометрии? Назовите рабочие и установочные вещества. Напишите основное уравнение реакции. 8. Каким способом готовят рабочие растворы перманганата калия, дихромата калия, тиосульфата натрия? 9. В чем заключается суть перманганатометрического метода определения ионов железа (II) в соли Мора, написать реакцию. 10. Каким образом рассчитывается нормальность перманганата калия и масса ионов железа (II) в соли Мора? 11. В чем заключается сущность метода броматометрии? Как фиксируют точку эквивалентности в этом методе? 12. Какие рабочие вещества и способы титрования используют в иодометрии и иодиметрии? 13. Что происходит с I2 при взаимодействии с тиосульфатом натрия? 14. В чем заключается суть иодометрического метода определения ионов меди (II) в растворе её соли, написать реакцию. 15. Каким образом рассчитывается нормальность тиосульфата натрия и масс ионов меди (II) в растворе её соли?
ЗАДАЧИ
1. Рассчитать титр раствора йода, если аликвотная часть его равна 10,00 см3, а на ее титрование израсходовано 10,21 см3 раствора тиосульфата натрия молярной концентрацией 0,0514 моль/дм3. 2. Сколько граммов FeSO4 содержится в 500 см3 раствора, если на титрование 15,00 см3 его израсходовано 14,26 см3 раствора перманганата калия с титром, равным 0,003610 г/см3? 3. Какую навеску As2O3, содержащего 3 % примесей, следует взять, чтобы после растворения ее в мерной колбе вместимостью 250,00 см3 на титрование 20,00 см3 полученного раствора затрачивалось не более 25,00 см3 раствора I2 с титром, равным 0,005144 г/см3? 4. Навеску минерала 0,6211 г, содержащего железо, растворили в кислоте. На титрование всего раствора после восстановления железа до Fe2+ израсходовано 20,55 см3 раствора дихромата калия молярной концентрацией эквивалентов 0,1498 моль/дм3. Рассчитать массовую долю железа в минерале. 5. Какой объем раствора I2 молярной концентрацией 0,1000 моль/дм3 пойдет на титрование 20,00 см3 раствора, содержащего в 1 см3 0,0304 г SnSO4? 6. 15,00 см3 раствора SO2 оттитровали 22,50 см3 раствора перманганата калия молярной концентрацией 0,0101 моль/дм3. Рассчитать титр раствора SO2. 7. На титрование 15,00 см3 раствора Na2S2O3 израсходовано 15,73 см3 раствора иодата калия, содержащего 1,3140 г KIO3 в 200 см3 раствора. Рассчитать молярную концентрацию эквивалентов раствора тиосульфата натрия. 8. До какого объема надо довести раствор, содержащий 4,2486 г технического сульфита натрия, чтобы на титрование 15,00 см3 его расходовалось не более 20,00 см3 раствора перманганата калия титром 0,006214 г/см3? Массовая доля примесей в техническом сульфите натрия равна 2,79 %. 9.Навеску влажного образца равную 0,5130 г, содержащую оксид железа (II) растворили в серной кислоте и оттитровали 20,00 см3 раствора перманга
ната калия (К = 1,1000 к С( 10. Рассчитайте молярную концентрацию эквивалента раствора дихромата калия, если на титрование 20,00 см3 раствора K2Cr2O7 израсходовано 15,25 см3 раствора сульфата железа,
ОСНОВНЫЕ ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ ЛИТЕРАТУРА 1. Аналитическая химия. В 3 т. Т.1 Методы идентификации и определения веществ: учеб. для студ. вузов /А. А. Белюстин [и др.]; под ред. Л. Н. Москвина. – М: Издательский центр Академия», 2008. — 576 с. 2. Васильев, В. П. Аналитическая химия. В 2 кн. Кн. 1. Аналитическая химияя / В. П. Васильев. – М: Дрофа, 2003. — 384 с. 3. Основы аналитической химии /под ред. Ю. А. Золотова.—М.: Химия, 1999. — Кн. 1-2. — 380 с. 4. Кунце, У., Основы качественного и количественного анализа./У. Кунце, Г. Шведт. – М.: Мир,1997. — 424 с.
Министерство образования и науки РФ Бийский технологический институт (филиал) федерального государственного бюджетного образовательного учреждения высшего профессионального образования «Алтайский государственный технический университет Им. И.И. Ползунова»
Н. В.Степанова
Автор Н. В.Степанова Зав. кафедрой……………………...…………....А.Л. Верещагин Председатель ФК МКО………………..………В.В. Еремина
Нормоконтролер………………............……….Е.А. Морозова
Зав. библиотекой……………………….……….О.В. Перышкина
Редактор…………………….…………………...
Первый зам. директора по УР…………..… ….В.А. Харитонов Бийск Издательство Алтайского государственного технического университета им. И.И. Ползунова
Н. В. Степанова
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ (РЕДОКСИМЕТРИЯ)
Методические рекомендации по выполнению лабораторной работы по дисциплине «Аналитическая химия» для студентов специальности 18.05.01 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 19.03.01 «Биотехнология» и 19.03.02 «Продукты питания из растительного сырья» всех форм обучения
Бийск Издательство Алтайского государственного технического университета им. И.И.Ползунова
УДК 543. 06(075.8) Рецензент: профессор, кандидат химических наук Ю.В. Мороженко Работа подготовлена на кафедре общей химии и экспертизы товаров Степанова, Н.В. Окислительно-восстановительное титрование (редоксиметрия): методические рекомендации по выполнению лабораторной работы по курсу «Аналитическая химия» для студентов специальности 18.05.02 «Химическая технология энергонасыщенных материалов и изделий» и направлений подготовки 19.03.01 «Биотехнология» и 19.03.02 «Продукты питания из растительного сырья» всех форм обучения / Н.В. Степанова; Алт. гос. техн. ун-т БТИ. – Бийск: Изд-во Алт. гос. техн. ун-та, 2014. –22 с. В методических рекомендациях приведены теоретические сведения по теме данной лабораторной работы. Изложена методика проведения экспериментов. Для закрепления материала предусмотрены контрольные вопросы и задачи. Работа выполнена в рамках современных требований СМК к изложению и качеству учебно-методического материала. Методические рекомендации составлены в соответствии с государственными стандартами высшего образования указанной специальности и направлений.
УДК 543. 06(075.8)
Рассмотрены и одобрены на заседании кафедры общей химии и экспертизы товаров Протокол № 5 от 03.06. 2014 г
Содержание
ВВЕДЕНИЕ Изучение дисциплины «Аналитическая химия» должно способствовать решению следующих задач: - освоению студентами качественных и количественных химических методов анализа для оценки качества и идентификации органических, неорганических веществ, биологически активных веществ и лекарственных препаратов; - изучению теоретических основ методов анализа сырья, готовой продукции и объектов окружающей среды; - получению студентами прочных практических навыков в области физико-химических методов анализа, применяемых при аналитическом контроле производства заводскими лабораториями предприятий важнейших отраслей промышленности и в лабораториях НИИ. Изучение дисциплины «Аналитическая химия» должно способствовать формированию у студентов следующих профессиональных компетенций по видам деятельности: Направление подготовки 19.03.01 «Биотехнология» - стремиться к саморазвитию, повышению своей квалификации и мастерства, приобретать новые знания в области техники и технологии, математики, естественных, гуманитарных, социальных и экономических наук (ОК-7); - быть способным и готовым использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ПК-1); - использовать знания о современной физической картине мира, пространственно-временных закономерностях, строении вещества для понимания окружающего мира и явлений природы (ПК-2); - уметь работать с научно-технической информацией, уметь использовать отечественный и зарубежный опыт в профессиональной деятельности, систематизировать и обобщать информацию по использованию ресурсов производства (ПК-6); - владеть планированием эксперимента, обработкой и анализом полученных результатов (ПК-8). Направление подготовки 19.03.02 «Продукты питания из растительного сырья»
- использовать основные законы естественнонаучных дисциплин в профессиональной деятельности, применять методы математического анализа и моделирования, теоретического и экспериментального исследования (ОК-10); - обладать способностью определять и анализировать свойства сырья и полуфабрикатов, влияющие на оптимизацию технологического процесса и качество готовой продукции, ресурсосбережение, эффективность и надежность процессов производства (ПК-4). Специализация 18.05.01 «Химическая технология энергонасыщенных материалов и изделий» - обладать пониманием экологических и технологических последствий своей профессиональной деятельности, роли охраны окружающей среды и рационального природопользования для сохранения и развития цивилизации (ОК-10); - обладать способностью применять современные методы исследования, проводить стандартные и сертифицированные испытания материалов, изделий и технологических процессов (ПК-21); - обладать способностью планировать и проводить необходимый эксперимент, корректно обрабатывать его результаты и анализировать полученные результаты (ПК-22); - обладать способностью изучать научно-техническую информацию, отечественный и зарубежный опыт по тематике исследований (ПК-23).
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 400; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.156.26 (0.013 с.) |

 .
. KMnO4)=0,1000 моль/дм3). Вычислите массовую долю оксида железа в образце.
KMnO4)=0,1000 моль/дм3). Вычислите массовую долю оксида железа в образце.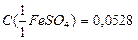 моль/дм3.
моль/дм3.


