
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Краткая характеристика методаСодержание книги
Поиск на нашем сайте
Медь, как и другие окислители в иодометрии, определяют по методу замещения согласно реакции:
Для того, чтобы восстановление меди было полным и проходило не слишком медленноследует создать в анализируемом растворе оптимальную кислотность (pH = 3-4), при которой медь (II) не подвергается гидролизу, а иодид следует добавлять в большом избытке. Выделившийся в результате этой реакции иод затем оттитровывают тиосульфатом натрия с известной концентрацией. Первичным стандартом для раствора тиосульфата в данной работе служит раствор иода, приготовленный по точной навеске или из фиксанала. Порядок проведения работы Стандартизация тиосульфата натрия Готовят 0,025н раствор иода из фиксанального раствора. В колбу для титрования отбирают 10,00 см3 стандартного раствора иода, затем добавляют 2-3см3 1%-ного раствора крахмала и титруют раствор медленно при энергичном перемешивании до исчезновения синей окраски. В конечной точке титрования окраска раствора должна быть бесцветной. Из 3-4 сходящихся результатов титрования рассчитывают среднее значение нормальной концентрации раствора тиосульфата. 2.2.2.2Определение массы ионов меди (II) В колбу для титрования отбирают определенное количество анализируемого раствора меди и прибавляют 14-15 см3 20%-ного раствора иодида калия (или 0,5-0,6 г иодида калия). Колбу накрывают часовым стеклом, дают смеси постоять в темном месте около 5 мин, после этого оттитровывают анализируемый раствор со взмученным осадком раствором тиосульфата натрия до бледно-желтой окраски. К раствору прибавляют 3-4 см3 крахмала и продолжают титровать до исчезновения синей окраски от прибавления оной капли титранта. Взмученный осадок CuI по окончании титрования должен иметь цвет слоновой кости. Точное титрование проводят не менее трех раз и из сходящихся отсчетов (разница между ними должна быть не более 0,1 см3 вычисляют среднее. Обработка результатов анализа Рассчитывают нормальность раствора тиосульфата натрия (С Na2S2O3) по формуле:
Массу ионов меди (II) рассчитывают по формуле: mСu Поскольку ион Cu2+ теряет в этой реакции один электрон, молярная масса эквивалента меди (M Cu) равна её молекулярной массе. Содержание отчета о работе
Отчет должен содержать следующие разделы: - цель работы;
- основные теоретические положения, используемые в данной работе; - расчетные формулы, уравнения и расчеты по ним; - выводы о проделанной работе; - решение задач. 2.2.5 Необходимые реактивы: 1.Тиосульфат натрия» 0,1М раствор. 2. Раствор иода, первичный стандарт. 3. Иодид калия, свежеприготовленный 20%-ный раствор или кристаллический. 4. Крахмал, свежеприготовленный 1%-ный раствор.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие реакции используют в методах редоксиметрии? 2. Какие вещества можно определять методом редоксиметрии? 3. Какие применяют способы фиксирования точки эквивалентности? 4. Объясните механизм действия редокс-индикаторов. Как их выбирают для титрования? 5. Какие факторы и как они влияют на скорость реакций окисления-восстановления? 6. Как классифицируют методы окисления-восстановления? 7. В чем сущность перманганатометрии? Назовите рабочие и установочные вещества. Напишите основное уравнение реакции. 8. Каким способом готовят рабочие растворы перманганата калия, дихромата калия, тиосульфата натрия? 9. В чем заключается суть перманганатометрического метода определения ионов железа (II) в соли Мора, написать реакцию. 10. Каким образом рассчитывается нормальность перманганата калия и масса ионов железа (II) в соли Мора? 11. В чем заключается сущность метода броматометрии? Как фиксируют точку эквивалентности в этом методе? 12. Какие рабочие вещества и способы титрования используют в иодометрии и иодиметрии? 13. Что происходит с I2 при взаимодействии с тиосульфатом натрия? 14. В чем заключается суть иодометрического метода определения ионов меди (II) в растворе её соли, написать реакцию. 15. Каким образом рассчитывается нормальность тиосульфата натрия и масс ионов меди (II) в растворе её соли?
ЗАДАЧИ
1. Рассчитать титр раствора йода, если аликвотная часть его равна 10,00 см3, а на ее титрование израсходовано 10,21 см3 раствора тиосульфата натрия молярной концентрацией 0,0514 моль/дм3. 2. Сколько граммов FeSO4 содержится в 500 см3 раствора, если на титрование 15,00 см3 его израсходовано 14,26 см3 раствора перманганата калия с титром, равным 0,003610 г/см3? 3. Какую навеску As2O3, содержащего 3 % примесей, следует взять, чтобы после растворения ее в мерной колбе вместимостью 250,00 см3 на титрование 20,00 см3 полученного раствора затрачивалось не более 25,00 см3 раствора I2 с титром, равным 0,005144 г/см3?
4. Навеску минерала 0,6211 г, содержащего железо, растворили в кислоте. На титрование всего раствора после восстановления железа до Fe2+ израсходовано 20,55 см3 раствора дихромата калия молярной концентрацией эквивалентов 0,1498 моль/дм3. Рассчитать массовую долю железа в минерале. 5. Какой объем раствора I2 молярной концентрацией 0,1000 моль/дм3 пойдет на титрование 20,00 см3 раствора, содержащего в 1 см3 0,0304 г SnSO4? 6. 15,00 см3 раствора SO2 оттитровали 22,50 см3 раствора перманганата калия молярной концентрацией 0,0101 моль/дм3. Рассчитать титр раствора SO2. 7. На титрование 15,00 см3 раствора Na2S2O3 израсходовано 15,73 см3 раствора иодата калия, содержащего 1,3140 г KIO3 в 200 см3 раствора. Рассчитать молярную концентрацию эквивалентов раствора тиосульфата натрия. 8. До какого объема надо довести раствор, содержащий 4,2486 г технического сульфита натрия, чтобы на титрование 15,00 см3 его расходовалось не более 20,00 см3 раствора перманганата калия титром 0,006214 г/см3? Массовая доля примесей в техническом сульфите натрия равна 2,79 %. 9.Навеску влажного образца равную 0,5130 г, содержащую оксид железа (II) растворили в серной кислоте и оттитровали 20,00 см3 раствора перманга
ната калия (К = 1,1000 к С( 10. Рассчитайте молярную концентрацию эквивалента раствора дихромата калия, если на титрование 20,00 см3 раствора K2Cr2O7 израсходовано 15,25 см3 раствора сульфата железа,
ОСНОВНЫЕ ТРЕБОВАНИЯ ТЕХНИКИ БЕЗОПАСНОСТИ
|
||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 320; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.85.59 (0.01 с.) |


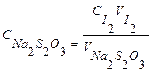 .
. .
. KMnO4)=0,1000 моль/дм3). Вычислите массовую долю оксида железа в образце.
KMnO4)=0,1000 моль/дм3). Вычислите массовую долю оксида железа в образце.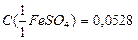 моль/дм3.
моль/дм3.


