Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы титриметрического метода анализа.Содержание книги
Поиск на нашем сайте
Титриметрический анализ основан на измерении количества реактива, затраченного на реакцию с определяемым веществом, и заключается в точном определении объема раствора химического реагента, необходимого при данном анализе. Точность определения объема раствора достигается с помощью технического приема, называемого титрованием. Титрование - постепенное прибавление титрованного раствора к исследуемому раствору. Титрованный раствор, или стандартный – это раствор, с точно известной концентрацией. Такой раствор называется титрантом. В процессе титрования наступает момент завершения реакции между титрантом и анализируемым веществом, называемый точкой эквивалентности. В данный момент количество реагирующих веществ в смеси становится эквивалентным, что отмечается величиной объёма рабочего раствора, пошедшего на титрование. Поэтому для расчета количества вещества можно использовать закон эквивалентности, т. е. отношение: m1 : Э1 = m 2 : Э 2 (1).
Отношение m: Э = n, где n- количество моль - эквивалентов реагирующих веществ, это значит, что в точке эквивалентности:
n 1 = n 2 (2)
В то же время n можно рассчитать исходя из формулы: С N = n/V, где C N – молярная концентрация эквивалента и тогда: n = C N ∙ V (3) Подставляя уравнение (3) в уравнение (2) получаем основную формулу расчёта в объёмном анализе, т. е.
C N 1 ∙ V1 = C N 2 ∙ V2 (4)
Часто C N заменяют на N (нормальность) и в этом случае приведенная формула в упрощённом виде будет выглядеть следующим образом:
N1V1=N2V2 (5)
Для расчётов часто применяют также величину, называемую титром. Титр – это количество граммов растворенного вещества в 1мл раствора, обозначаемый буквой Т с индексом справа внизу, указывающим название растворенного рабочего вещества. Например, ТНС1 или ТКMnO4. Титр рассчитывают по следующим формулам:
Т = N ∙ Э /1000 или Т = m / V (г/мл) (6)
В некоторых случаях удобно выражать титр не в граммах рабочего вещества, а в граммах определяемого вещества, реагирующего с 1 мл рабочего раствора. Такой титр называют титром по определяемому веществу. Например, ТKMnO4 / Fe = 0,00562 г/мл, это означает, что 1 мл раствора KMnO4 окисляет 0, 00562 г железа. В титриметрическом методе анализа применяют в зависимости от задач, три способа (или приема) титрования: прямое, заместительное и обратное. Прямое титрование заключается в постепенном добавлении титранта к анализируемому раствору до достижения точки эквивалентности по следующему уравнению: аА + bВ = dD + сС например: HCl + NaOH ---> NaCl + Н2O Заместительное (косвенное) титрование заключается в том, что к определённому веществу добавляют специальный реагент, вступающий с ним в реакцию, один из продуктов взаимодействия затем оттитровывается рабочим раствором - титрантом. Общее уравнение Пример: A + BZ ---> AB + Z 2Cu2+ + 4KJ ----> 2СuJ + J2 + 4К+. Z + C ----> CZ J2 + 2Na2S2O3 ----> 2NaJ + Na2S4O6 титрант титрант Обратное титрование заключается в добавлении к анализируемому веществу точно известного избытка титранта (1), остаток которого после реакции оттитровывают с помощью титранта (2). A + B -----> D (титрант 1) в избытке B + C ------> Z Избыток титрант 2 титранта 1
Например: 1) NaCl + AgNO3 ----> AgС1 + NaNO3 Титрант 1 (избыток) 2) AgNO3 + (NH4)CNS ----> AgCNS + NH4NO3 оставшийся титрант 2 избыток
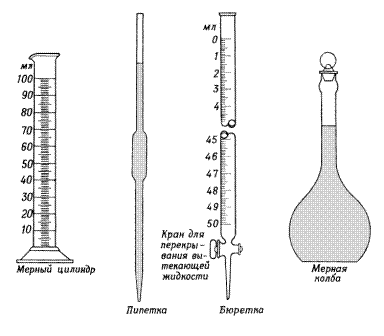
По каждому способу титрования проводятся необходимые расчётына основании закона эквивалентов. К реакциям в объёмном анализе предъявляются определённые требования. 1.Реакции должны быть практически необратимыми. 2.Реакция должна протекать в строгом соответствии с уравнением химической реакции без побочных продуктов 3. Реакция должна протекать достаточно быстро. 4.Должна быть чёткая фиксация конца титрования, т.е. точки эквивалентности. Выбор способа фиксирования решается применительно к конкретным условиям. В объёмном анализе необходимо знать точную концентрацию и объёмы растворов реагирующих веществ. Для измерения объёмов жидкости с точностью до 0,01 – 0,03 см3 используется специально мерная посуда: мерные колбы, бюретки, пипетки, мерные цилиндры, мензурки и др. (рис.1)
Рис. 1. Посуда, используемая в химии для измерения объема
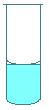
Для точного измерения объёма соблюдают некоторые правила: 1. Глаз экспериментатора должен находится на одном уровне с мениском измеряемой жидкости. 2. Объём прозрачных жидкостей отмеряют по нижнему мениску (рис. 2,а). Объём интенсивно окрашенных и вязких жидкостей – по верхнему мениску (рис. 2,б и 2,в).
а б в
Рис. 2. Формы менисков в стеклянных трубках.
а – прозрачная жидкость; б – интенсивно окрашенная жидкость; в – вязкая жидкость. Мерные колбы предназначены для приготовления растворов титранта, первичных стандартов, анализируемых проб. Мерные колбы бывают различной вместимости (от 2000 см3 до 25 см3). На узком и длинном горлышке колбы имеется метка, а на широкой части указан номинальный объём.
Пипетки предназначены для отмеривания и переноса заданного объёма раствора из одного сосуда в другой. Различают пипетки Мора, рассчитанные на один объём, обозначаемый меткой на узкой части и градуированные пипетки. Для заполнения пипетки нижний конец её опускают в раствор почти до дна, с помощью резиновой груши заполняют раствор выше метки, затем плотно закрывают верхнее отверстие указательным пальцем. Держа пипетку вертикально, осторожно ослабляют давление пальца и дают избытку раствора стекать по каплям, чтобы мениск установился точно против метки. Вновь плотно закрыв пипетку пальцем, осторожно перенести в приготовленный сосуд и, открыв отверстие, дают жидкости медленно вытекать, наблюдая за тем, чтобы отверстие пипетки не касалось раствора в сосуде. Оставшиеся капли раствора в кончике пипетки выдувать запрещается, так как объем этих капель учтен при калибровке. Бюретки предназначены для измерения объёма вытекающей из них жидкости. Обычные лабораторные бюретки представляют собой стеклянные градуированные цилиндрические трубки, снабжённые затвором. В качестве затворов чаще всего используется стеклянный кран или резиновая трубка с затвором шарикового типа, с металлическим зажимом. Для проведения титрования бюретки устанавливают в штативе строго вертикально, заполняют титрантом с помощью воронки выше нулевой отметки. Затем освобождают кончик бюретки от пузырьков воздуха, слегка приподнимая резиновую трубку и надавливая на неё в месте расположения стеклянного шарика. После этого снимают воронку (вставляют ее в отверстие на штативе, рядом в бюреткой) и устанавливают уровень раствора на нулевой отметке. Титровать из бюретки необходимо медленно при постоянном перемешивании раствора в колбе для титрования, чтобы выяснить, на какой капле титранта наступает конец титрования. После этого отмечают по бюретке объем раствора, пошедшего на титрование исследуемого вещества. Последовательность действий процесса титрования показана на рис. 3. Перед работой любую мерную посуду тщательно моют сначала хромовой смесью или раствором (0,1 н) хлороводородной кислоты, после этого ополаскивают дистиллированной водой. В мерной посуде нельзя нагревать жидкости и наливать в нее горячие растворы.
|
||||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 2929; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.251.204 (0.009 с.) |