
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислотно-основное титрование.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Метод кислотно-основного титрования широко применяется в клинических анализах, санитарно-гигиенических и токсикологических исследованиях, в фармации, при анализе лекарственных препаратов и т.д. В основе кислотно-основного метода титрования лежат реакции между кислотами и основаниями, поэтому этот метод подразделяется в свою очередь на ацидиметрический и алкалиметрический. В ацидиметрии в качестве титрантов применяют 0,01-0,1 N растворы сильных кислот (HCl и H2SO4) для определения оснований, солей слабых кислот, аминов и их производных.
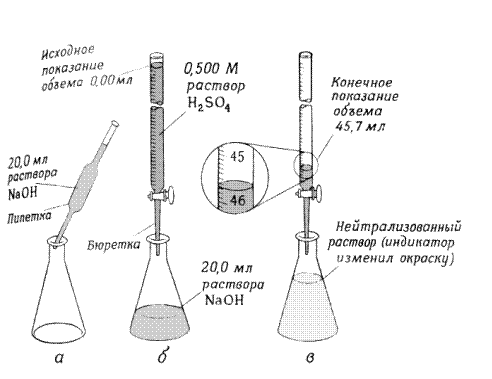
Рис. 3. Способ титрования неизвестного основания стандартным раствором H2SO4: а - известное количество основания помещают в колбу; б - к основанию добавляют кислотно-основный индикатор, а затем из бюретки медленно приливают стандартный раствор H2SO4; в - точку эквивалентности устанавливают по изменению окраски индикатора. В ацидиметрии в качестве титрантов применяют 0,01-0,1 N растворы сильных кислот (HCl и H2SO4) для определения оснований, солей слабых кислот, аминов и их производных. Так как серная кислота гигроскопична, а соляная летуча, то установку точной концентрации этих веществ проводят по стандартным растворам (первичный стандарт), например, тетраборат натрия - бура (Na2B4O7 * 10 H2O). Алкалиметрию применяют для определения сильных и слабых кислот (H2BO3, HCl, CH3COOH), а так же фенолов и солей слабых оснований, например, хлорида аммония NH4Cl. Титрантами в данном случае являются 0,01-0,1 N растворы сильных оснований (NaOH, KOH). Стандартным титрантом в данном случае является раствор щавелевой кислоты - H2 С2O4 * 5 Н2О. В основе метода кислотно-основного титрования лежит реакция нейтрализации, сущность которой заключается в следующем уравнении:
H3О+ + OH- → 2Н2О
простейшем виде: Н + + ОН - →Н2О
При этом ионы водорода H+ кислоты связываются ионами OH - оснований, т.е. при титровании (прибавления малых порций из бюретки) кислоты к щелочи происходит постепенное уменьшение концентрации ионов Н+, а количество ионов ОН- увеличивается. Таким образом, уменьшение концентрации кислоты можно отслеживать по изменению концентрации ионов водорода. В точке эквивалентности, т.е. в конце титрования, концентрация ионов водорода [H+] практически должна быть равна концентрации гидроксид - ионов [OH-]. Как показали исследования, величина концентрации ионов водорода, в данном случае, равна 10 -7 г-ион/л. На практике вместо концентрации водородных ионов используют понятие «водородный показатель», обозначаемый – рН и равный отрицательному десятичному логарифму из концентрации водородных ионов, т.е. рН = - lg [H+] Значит, если [H+] =10-7 г-ион/л, то рН = - lg10-7= 7. Такое значение рН обозначает нейтральную среду. Это значит, что в этом случае и [OH-]=10-7, а рОН = 7.Таким образом в нейтральной среде сумма рН + рОН = 14.. При рН > 7 среда раствора будет щелочной, при рН < 7 кислой. Величина рН в точке эквивалентности зависит от природы кислоты или основания, вступающих в реакцию нейтрализации. Различают четыре типа кислотно-основных реакций, в результате которых образуется соль и вода. 1) Реакция между сильной кислотой и сильным основанием: HCl + NaOH → NaCl + H2O В ионном виде: H + + Cl - + Na+ + OH- → Na+ + Cl- + H2O Сокращённое ионное уравнение: H + + ОН - → H2О В точке эквивалентности будет нейтральная среда и рН = 7. Соль NaCl не подвергается гидролизу и реакция необратима.
2) Реакция между слабой кислотой и сильным основанием: CH3COOH + NaOH → CH3COONa + H2O В ионном уравнении не диссоциирует слабая уксусная кислота, так как в растворе присутствуют сильные электролиты - основание и соль. CH3COOH + Na+ + OH- → CH3COO- + Na+ + H2O И сокращенное уравнение показывает, что в точке эквивалентности образуется избыток ОН- ионов, т.е. рН > 7. СH3COOH + OН- → CH3COO- + H2O Кроме того, происходит гидролиз соли CH3COONa, что еще увеличивает число ОН- ионов. Гидролиз идет по следующему уравнению: CH3COO- + Na+ + H2O ↔ CH 3COOН + Na+ + ОН- т.е. идет обратимый процесс. 3) Реакция между сильной кислотой и слабым основанием: HCl + NH 4OH ↔ NH 4Cl + H2O Гидроксид аммония Слабое основание
в ионном виде: H+ + Cl- + NH 4OH ↔ NH4+ + Cl- + H2O или сокращенно: Н+ + NH4 OH ↔ NH+4 + H 2O Эта реакция так же обратима, т.к. соль NH 4Cl подвергается гидролизу по уравнению: NH+4 + Cl- + H 2O ↔ NH 4OH + H+ + Cl- В точке эквивалентности реакция среды будет кислой, т.е. рН < 7
4) Реакция между слабой кислотой и слабым основанием: CH 3COOH + NH 4OH → CH 3COONH4 + H 2O. При данной реакции изменение рН происходит очень медленно, и момент эквивалентности определить невозможно, поэтому такие реакции не имеют для объемного анализа значения. Фиксирование точки эквивалентности по изменению рН в процессе титрования проводят с помощью кислотно-основных индикаторов. Кислотно – основные индикаторы – это сложные органические вещества, которые изменяют свою окраску в зависимости от рН среды. Они являются либо слабыми кислотами HJnd, либо слабыми основаниями – JndOH. В водных растворах кислотные индикаторы диссоциируют по схеме:
HJnd ↔ H+ + Jnd - Заряженные частицы Jnd - - сложные органические ионы, имеющие окраску, отличающуюся от окраски молекулярной, неионизированной формы. Если к водному раствору HJnd добавить немного NaOH, то гидроксидные ионы ОН - будут соединяться с ионами Н +, образуя H2O. Вследствие принципа Ле-Шателье равновесие диссоциации индикатора сдвигается вправо и раствор меняет окраску на окраску свободных ионов Jnd- Если к тому же раствору прибавить HCl, то есть Н+, то равновесие сдвинется в сторону образования HJnd и появится окраска недиссоциированных молекул. Известны одноцветные и двухцветные индикаторы. К одноцветным относится фенолфталеин, который в кислой и нейтральной среде – бесцветный, а в щелочной среде имеет малиновый цвет. К двухцветным индикаторам относится метиловый оранжевый. В кислой среде этот индикатор имеет розовую окраску, в щелочной – жёлтую, а в нейтральной среде – более насыщенную оранжевую окраску. Каждый индикатор имеет определённый интервал перехода окраски, представляющий собой тот промежуток между двумя значениями рН, в котором изменяется окраска. Величина интервала перехода – Среднее значение рН в интервале перехода окраски называется точкой перехода индикатора или показателем титрования. На практике, при титровании, показатель титрования есть конец реакции между кислотой и основанием. Значит точка перехода индикатора – есть точка конца титрования. Значения рН для различных индикаторов представлено в таблице 2.
Таблица 2.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-17; просмотров: 1685; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.007 с.) |

 рН, обычно не превышает двух единиц. Так у фенолфталеина
рН, обычно не превышает двух единиц. Так у фенолфталеина 


