Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нарушение кислотно-основного состоянияСодержание книги
Похожие статьи вашей тематики
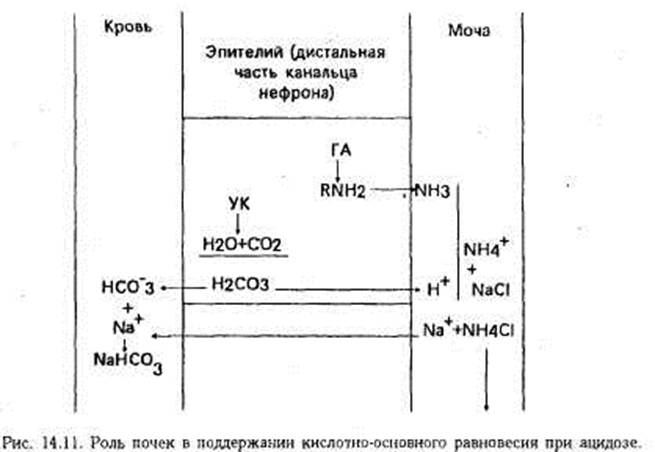
Поиск на нашем сайте Постоянство рН внутренней среды является необходимым условием существования высших организмов. Оно обеспечивается определенным соотношением кислот и оснований (кислотно-основное состояние — КОС) в биологических средах, при нарушении которого (выход рН за пределы 6,8 — 7,8) организм погибает. Нарушения КОС наблюдаются при многих заболеваниях, отягощают их течение и подлежат коррекции (рис. 14.10). В зависимости от направления сдвига рН (водородного показателя) крови, нарушения кислотно-основного состояния подразделяются на ацидоз и алкалоз. Если рН крови не выходит за пределы нормы (7,35 — 7,45), ацидоз или алкалоз называется компенсированным. Если же регуляторные механизмы недостаточны и отклонения рН становятся выраженными, то такие состояния называются декомпенсированными. По механизму развития ацидоз или алкалоз бывает газовым (респираторным), развивающимся при нарушении обмена и транспорта СО2, и негазовым (метаболическим), который возникает при накоплении в организме нелетучих продуктов кислого и основного характера. Устранение сдвига рН в организме осуществляется с помощью физико-химических и физиологических механизмов регуляции. Первыми, наряду с разведением кислот и оснований внеклеточной жидкостью, включаются буферные системы крови. Биологический буфер состоит из кислого (донор Н-) и основного (акцептор Н+) компонентов, соотношение между которыми при нормальном рН является величиной постоянной. Исходя из этого, соляная кислота, например, является более сильной, чем угольная, а анион Сl- по сравнению с НСО3- обладает менее выраженными основными свойствами, так как слабее удерживает возле себя ионы водорода. Основными буферами организма являются четыре: гидрокарбонатный Н2СО3/NaHCO3 = 1/19, который действует в основном в крови; фосфатный NaH2P04/Na2HPO4 = 1/4 — в почках и других тканях; белковый (NH2 — R — СООН) и гемоглобиновый НвО2/Нв. В зависимости от того, где функционирует буфер — в жидкой среде или клетках, в состав его компонентов будет соответственно входить Na или К. Гидрокарбонатный буфер не обладает большой емкостью, однако является самым лабильным из буферов. Поэтому определение его компонентов в качестве индикаторов КОС (напряжение СО2в крови, отражающее концентрацию угольной кислоты, и содержание гидрокарбоната) имеют большое диагностическое значение. Буферные свойства белков связаны с их амфолитностью. В щелочной среде белки функционируют как кислоты, отдавая (взамен на Na- и К-) ионы водорода от своих карбоксильных групп. В кислой среде, выполняя роль оснований, они работают наоборот; ионы водорода при этом могут также связываться группой NH2, превращая ее в NH3-. Самым емким буфером является гемоглобиновый. На его долю приходится до 75 % всей буферной емкости крови. Гемоглобин, как известно, является белком — амфолитом, буферные свойства которого в основном связаны с существованием двух его форм: окисленной и восстановленной. В окисленной форме гемоглобин проявляет свои кислотные свойства (т. е. способность диссоциировать с отдачей Н--ионов) и в 70 — 80 раз сильнее, чем восстановленный. Вместо отданных ионов водорода он связывает соответственно больше, чем восстановленный, ионов калия из КНСО3, находящегося в эритроцитах. Восстановленный Нв, выполняющий роль основания, наоборот, присоединяет ионы водорода и отдает ионы калия. Кроме того, 10 — 15 % углекислого газа из тканей гемоглобин транспортирует в виде нестойкого соединения карбогемоглобина. При необходимости этот процент может увеличиваться до 30. Главные клеточные буферы — это белковый и фосфатный. Буферная система способна нейтрализовать избыток как кислот, так и оснований в организме, переводя их в форму, удобную для выведения. Так как продукты этих реакций тоже являются кислотами и основаниями, хотя и более слабыми, сдвиг рН только смягчается, но не ликвидируется. Полная нормализация кислотно-основного состояния происходит только с помощью физиологических механизмов компенсации, которые выводят кислоты и основания из организма и восстанавливают нормальное соотношение компонентов буферных систем. Это происходит в основном вследствие быстрого включения дыхательного механизма (обеспечивается выделение летучих продуктов) и почек (выводятся нелетучие вещества). Значительно меньшую роль в этом играют желудок, кишки, кожа. Участие легких в восстановлении рН выражается в изменении их вентиляции, интенсивность которой регулируется рСО2 и рН крови. Почки осуществляют регуляцию содержания кислот и оснований в организме с помощью трех основных процессов: Ацидоз. Газовый ацидоз развивается при избытке в организме углекислоты вследствие нарушения ее выведения легкими. Причиной этого чаще всего является снижение альвеолярной вентиляции при заболеваниях легких или угнетении дыхательного центра наркотиками, барбитуратами. Кроме того, газовый ацидоз возникает при вдыхании газовых смесей с высоким содержанием СО2 Избыток СО2 в крови обусловливает повышение концентрации Н2СО3, которая образуется в эритроцитах. Соотношение H2CO3/NaHCO3становится более 1/19. Компенсация в данном случае будет заключаться в восстановлении этого соотношения вследствие уменьшения содержания угольной кислоты и увеличения содержания гидрокарбонатов. Решающая роль в компенсации газового ацидоза принадлежит гемоглобиновому (в меньшей степени белковому) буферу и почкам. Избыток Н- -ионов, образующихся при диссоциации угольной кислоты, в значительной степени удерживается в эритроцитах восстановленным гемоглобином, выполняющим роль основания. Освободившийся анион НСО3- частично связывается с К+ гемоглобина, а в основном, отчасти в обмен на Сl-, поступает в плазму, где соединяется с ионами натрия (из NaCl, белков и фосфатов). В результате этого повышается содержание гидрокарбоната. Некоторое количество ионов водорода при газовом ацидозе связывается белками,- которые ведут себя в данном случае как основания. Таким образом, большая часть избытка СО2 в крови преобразуется в гидрокарбонат вследствие действия угольной ангидразы эритроцитов и гемоглобинового буфера (в меньшей степени белкового). Роль почек в компенсации газового ацидоза заключается в усилении секреции Н--ионов. Кислотность мочи повышается. Аммониогенез может быть несколько увеличен. Если газовый ацидоз долго не ликвидируется, выраженная гиперкапния может привести к вторичным явлениям повреждения. Так, возникающий в периферических тканях спазм артериол вызывает повышение артериального давления и тем самым затрудняет работу сердца. Спазм почечных сосудов снижает образование мочи. Сосуды головного мозга под влиянием СО2, напротив, расширяются, вследствие чего увеличивается внутричерепное давление. Значительная концентрация СО2 в крови повышает возбудимость блуждающего нерва, а это в свою очередь может привести к остановке сердца, а также спазму бронхиол и усилению секреции слизи в них, что дополнительно затрудняет дыхание. Иногда газовый ацидоз осложняется негазовым, так как нарушение дыхания обычно приводит к недостаточному поступлению кислорода в организм и накоплению в тканях недоокисленных продуктов обмена. Негазовый ацидоз является самой грозной и наиболее часто встречающейся формой нарушений кислотно-основного равновесия. Развивается он при накоплении в крови нелетучих кислых продуктов обмена вследствие избыточного образования, недостаточного выведения или избыточного введения их в организм (глубокая гипоксия, сахарный диабет, голодание, тяжелые поражения печени и почек и др.). Причиной негазового ацидоза может быть также значительная потеря гидрокарбонатов в составе щелочного кишечного сока. Наиболее быстро и тяжело развивается негазовый ацидоз при кислородном голодании вследствие глубоких нарушений кровообращения (остановка сердца, шок, коллапс и др). Неизбежным осложнением при этом является ослабление выведения из крови СО2 и присоединение газового ацидоза. Нейтрализация высокой концентрации Н- -ионов, имеющая компенсаторное значение при негазовом ацидозе, осуществляется прежде всего путем связывания их NaHCO3 — основным компонентом гидрокарбонатного буфера. В результате реакции наблюдается уменьшение количества вступающего в реакцию NaHCO3, образование угольной кислоты и натриевой соли нейтрализованной кислоты. При этом изменяется соотношение между числителем и знаменателем в формуле гидрокарбонатного буфера в сторону преобладания числителя. Восстановление их нормального соотношения в результате увеличения концентрации NaHCO3 и уменьшения Н2СО3 происходит по мере дальнейшего включения компенсаторных реакций. Недостаток гидрокарбоната в плазме, являющийся главным показателем негазового ацидоза, компенсируется в значительной степени за счет обмена ионов между эритроцитами и плазмой: избыток угольной кислоты реагирует с NaCl и образует NaHCO3, H- и Сl-; анионы хлора уходят в эритроциты. Восстановление гидрокарбоната происходит отчасти за счет взаимодействия угольной кислоты с основаниями других буферных систем (белковой, фосфатной), а также "реабсорбции" его в почках. Главным механизмом ликвидации избытка угольной кислоты в организме является гипервентиляция легких. Будучи нестойкой, угольная кислота под влиянием карбоангидразы эритроцитов распадается на СО2 и Н2О. Высокая концентрация СО2 (как и снижение рН) возбуждает дыхательный центр, вызывая гипервентиляцию легких. Этому механизму, как и гидрокарбонатному буферу, принадлежит решающая роль в компенсации негазового ацидоза. В связывании избытка ионов водорода, вызвавших ацидоз, кроме гидрокарбонатного буфера, определенную роль играет и белковый. Частично излишки Н--ионов в обмен на К+перемещаются из плазмы в эритроциты и клетки тканей, что приводит к гиперкалиемии. Ионы водорода уходят также в костную ткань, обмениваясь на Na и Са2+. В плазме крови увеличивается концентрация катионов К+, Na+, Ca2+. Выделительная функция почек при негазовом ацидозе имеет меньшее значение, чем гипервентиляция легких. Поскольку рСО2 в крови при этом понижено, снижается и активность зависимых от этого процессов в эпителии канальцев нефрона — секреции Н--ионов и сопряженной с ней реабсорбции гидрокарбоната. Значительно повышается титрационная кислотность вследствие выделения фильтрацией нелетучих органических кислот, вызвавших, ацидоз (кетоновые тела, молочная кислота и др.); возрастает выделение аммиачных солей. Поддержание кислотно-основного равновесия при негазовом ацидозе достигается ценой изменения показателей других систем. Так, уменьшение в крови напряжения СО2может вызвать нарушение дыхания, а также снижение тонуса сосудов, приводящее к уменьшению почечного кровотока, а следовательно, и мочеобразования. Выделение в плазму ионов К+, Na+ и Са2+ из клеток и костной ткани в обмен на Н-может явиться причиной аритмии сердца, угнетения нервно-мышечной возбудимости, декальцинации костей и т. д. Алкалоз. Газовый алкалоз развивается при снижении напряжения СО2 в крови вследствие гипервентиляции легких. Причинами этого могут быть вдыхание разреженного воздуха при подъеме на высоту, поражения мозга, сопровождающиеся возбуждением дыхательного центра, чрезмерная искусственная вентиляция легких с помощью аппарата. Компенсаторные реакции при газовом алкалозе направлены на снижение концентрации гидрокарбонатов в крови и восстановление содержания угольной кислоты. Это обеспечивается за счет белков, которые в обмен на катионы натрия (из NaHCO3) отдают свои ионы водорода. Пополнение плазмы Н-ионами происходит также за счет ионов водорода из клеток крови и костной ткани в обмен на К+, Na+ и Са2+. Освободившиеся из депо ионы водорода, присоединяя НСО3- в плазме, восполняют утраченное при гипервентиляции легких количество Н2СО3-. Однако решающая роль в компенсации газового алкалоза принадлежит почкам. Вследствие снижения рСО2 при этой форме алкалоза в почках уменьшается секреция Н--ионов и реабсорбция гидрокарбонатов. Поэтому профильтровавшиеся гидрокарбонаты в значительном количестве появляются во вторичной моче. Реакция мочи щелочная, содержание титруемых кислот и аммиачных солей незначительно. Ионное равновесие в плазме при потере анионов НСО3- отчасти восстанавливается за счет ионов Сl-, поступающих из клеток и способствующих увеличению содержания хлоридов в плазме. Если при этом гипокапния резко выражена, может наблюдаться снижение тонуса сосудов и соответственно артериального давления. Выделение с мочой большого количества натрия гидрокарбоната способствует обезвоживанию организма. Снижение в крови концентрации ионизированного кальция вследствие ионообмена может привести к тетании. Негазовый алкалоз (метаболический) встречается реже ацидоза, хотя и не является редким патологическим состоянием. Причинами его могут быть избыточное поступление щелочей в организм (введение содовых растворов), рвота, когда вместе с желудочным соком теряется Сl- — слабое основание. Так как сумма оснований в организме имеет определенную величину и представлена в основном НСО3- и Сl-, то восстановление ионного равновесия при потере С1- происходит за счет НСО3- (сильное основание). Это вызывает сдвиг реакции в щелочную сторону. Негазовый алкалоз может развиться также при повышении секреции или избыточном введении в организм минералокортикоидов, которые вызывают потерю калия с мочой вследствие угнетения его реабсорбции в почках. Снижение концентрации К+ в клетках возмещается поступлением ионов натрия и водорода из плазмы крови. Концентрация Н- -ионов в плазме уменьшается, рН ее возрастает. Основным показателем негазового алкалоза является увеличение содержания гидрокарбонатов в крови. Компенсация, направленная на восстановление соотношения между компонентами гидрокарбонатного буфера, как и при негазовом ацидозе, осуществляется в определенной степени вследствие изменения функции дыхательной системы. Низкая концентрация Н--ионов вызывает угнетение дыхательного центра, что ведет к гиповентиляции легких (насколько это вообще возможно). Накопление вследствие этого в крови СО2частично компенсирует первичное увеличение содержания NaHCO3. В компенсации негазового алкалоза принимает участие белковый и фосфатный буферы, которые отдают в плазму свои Н--ионы, связывая при этом катионы Na+ из NaHCO3. Освобожденные анионы НСО3-, соединяясь с ионами водорода, частично восполняют дефицит угольной кислоты, а частично переходят в эритроциты в обмен на Сl-, что снижает щелочность плазмы. Плазменные белки, кальций — связывающие свойства которых при алкалозе усиливаются, могут также отдавать свои Н--ионы в обмен на Са2+ плазмы. Кроме того, количество Н--ионов в плазме может увеличиваться в результате поступления из костной ткани и эритроцитов в обмен на ионы Na+, К+, Са2+. Участие почек в компенсации негазового алкалоза выражается в выведении избытка гидрокарбонатов. В моче повышен уровень NaHCO3, реакция ее щелочная, титрационная кислотность снижена. Нарушения при негазовом алкалозе могут быть связаны прежде всего с выделением из организма большого количества Na+ в составе NaHCO3, способствующим снижению осмотического давления внеклеточной жидкости и потере большого количества воды. Потеря К+ может вызвать нарушение функции миокарда. При уменьшении в крови ионизированного Са2+ вследствие ионообмена повышается нервно-мышечная возбудимость, ведущая к развитию судорог. Принципы коррекции нарушений КОС заключаются в ликвидации сдвига рН внутренней среды организма путем нормализации состава буферных систем и устранения сопутствующих нарушений водно-электролитного обмена, ликвидации осложнений, а также лечении патологических процессов, вызывающих нарушения КОС или поддерживающих их.
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 880; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.013 с.) |