
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы окислительно-восстановительных реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Межмолекулярные ОВР – окислитель и восстановитель, разные вещества. Например: К2Cr2O7 + 6 KI + 4 H2SO4 → Cr2(SO4)3 + 3 I2 + K2SO4 + 4 H2O ок-ль вос-ль 2. Внутримолекулярные ОВР — атом-окислитель и атом- восстановитель входят в состав одного вещества. Например: 2 Cu(NO3)2 3. Реакции диспропорционирования — атом одного химического элемента является и окислителем, и восстановителем. Например: 3 Cl2 + 6 KOH → 5 KCl + KClO3 + 3 H2O 2 Н2О2 → 2 H2O + O2 Схему межмолекулярной ОВР можно представить следующим образом: Ок1 + Вос2 → Ок2 + Вос1, где пары Ок1 /Вос1 и Ок2 /Вос2 — сопряженные пары окислителей и восстановителей. Например, в химической реакции
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O Ок1 Вос2 Вос1 Ок2 сопряженными парами являются: MnO2 / Mn2+ и Сl2 / 2Cl-. Если ОВР протекает в водном растворе, то характеристикой каждой сопряженной пары служит окислительно-восстановительный потенциал (ОВП), обозначаемый φок/вос и измеряемый в Вольтах. В справочниках приводятся значения стандартных ОВП (φ0ок/вос), то есть потенциалов, измеренных при стандартных условиях. Стандартные ОВП изменяются в диапазоне от – 3 до + 3 В. Например, φ0 (Li+ / Li) = – 3,045 В φ0 (F2 / 2F‾) = + 2,87 В Чем меньше ОВП, тем сильнее восстановитель и слабее сопряженный с ним окислитель. Так, Li — самый сильный восстановитель, Li+ — самый слабый окислитель. Чем больше ОВП, тем сильнее окислитель и слабее сопряженный с ним восстановитель. Так, F2 – самый сильный окислитель, F- – самый слабый восстановитель. Зная ОВП, можно сравнивать силу окислителей и восстановителей. Например, можно сравнить окислительную способность KMnO4 в различных средах: φ0 (MnO4‾ / Mn2+) = 1,51 В φ0 (MnO4‾ / MnО2) = 0,60 В φ0 (MnO4‾ / MnО42‾) = 0,56 В. Очевидно, что окислительная способность KMnO4 сильнее всего выражена в кислой среде. Сила окислителей и восстановителей зависит от: а) природы, б) концентрации, в) температуры, г) иногда от рН. Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста (1889):
где F – постоянная Фарадея, 95500 Кл/моль; n – число отданных или принятых электронов; R – универсальная газовая постоянная, 8,31 Дж/ моль·К, Т – температура, К, [Ок] – молярная концентрация окисленной формы, моль/л; [Восст] – молярная концентрация восстановленной формы, моль/л; При Т = 298 К, можно рассчитать параметр данного уравнения, равный
Соответственно, уравнение Нернста примет вид:
Например, потенциал полуреакции MnO4‾ + 8H+ + 5 ē → Mn2+ + 4H2O можно рассчитать следующим образом:
Если ОВП описывает полуреакцию, то характеристикой всей окислительно-восстановительной реакции является ее электродвижущая сила (ЭДС или Е), измеряемая в Вольтах (В). ЭДС рассчитывается по уравнению: Е = φОк1/ Вос1–φ Ок2/ Вос2 Например, для реакции: KMnO4 + H2O2 + H2SO4 → MnSO4 + O2 + K2SO4 +H2O Ок1 Вос2 Вос1 Ок2 φ0 MnO4‾ / Mn2+ = 1,51 В φ0 O2 / H2O2 = 0,68 В Е0 = 1,51 – 0,68 = 0,83 В Рассчитав электродвижущую силу ОВ реакции, можно определить ее характер (само- или несамопроизвольный). Для этого необходимо установить взаимосвязь между эдс и изменением свободной энергии Гиббса (ΔrG). Электрическую работу, выполняемую при переносе электронов от восстановителя к окислителю Аэл, можно рассчитать двумя способами:
Aэл = – ΔrG Соответственно ΔrG = – n·F·E, Таким образом, если Е > 0, то ΔrG < 0 (реакция протекает самопроизвольно), а если E < 0, то ΔrG > 0 (реакция протекает несамопроизвольно ). Большинство ОВР имеют обратимый характер, поэтому их важной характеристикой является константа химического равновесия (К). Согласно уравнению химического сродства ΔrG0 = – RT·lnK, а с другой стороны изменение свободной энергии Гиббса можно рассчитать как ΔrG0 = – n·F·E0. Следовательно, n·F·E0 = RT·lnK, откуда следует, что ln K = Соответственно, K = При Т = 298 К константу равновесия можно рассчитать как K = Большинство биохимических реакций являются окислительно-восстановительными. Они играют важную роль в организме, выполняя две важнейшие функции: 1) пластическую — синтез сложных органических молекул, 2) энергетическую – выделение энергии при окислении сложных высокомолекулярных веществ (углеводов, жиров и белков). Энергоснабжение организма на 99% обеспечивается протеканием в нем окислительно-восстановительных процессов. Причем, 90% всей энергии выделяется при окислении углеводов и жиров, и лишь 10% — при окислении белков. Фармакологическое действие ряда лекарственных препаратов основано на их окислительно-восстановительных свойствах. Известно, что такие окислители как I2, H2O2, O3, KMnO4, HNO3 обладают бактерицидными свойствами. Например, натрий тиосульфат Na2S2O3 — это универсальное противоядие, применяемое при отравлениях тяжелыми металлами и хлором. Механизм действия этого препарата можно объяснить при помощи химических уравнений: Pb(CH3COOH)2 + Na2S2O3 + H2O → PbS + Na2SO4 + 2CH3COOH Cl2 + Na2S2O3 + H2O→2 HCl + S + Na2SO4. Под воздействием Na2S2O3 происходит связывание тяжелых металлов и выведение их из организма, а токсичный хлор превращается в соляную кислоту. Изучение механизмов возникновения электродных и окислительно-восстановительных потенциалов позволяет разобраться в закономерностях многих биохимических процессов в организме, в частности, в процессах биологического окисления, и установить энергетические характеристики окислительно-восстановительных процессов.
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 890; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.34.105 (0.007 с.) |

 2 CuO + 4 NO2 + O2
2 CuO + 4 NO2 + O2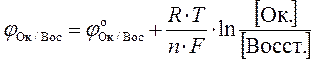

 ,
,
 Аэл = n·F·E
Аэл = n·F·E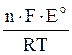

 .
.


