
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворимость газов, жидкостей и твердых веществ в водеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Растворимость (S) — это способность вещества растворяться в данном растворителе. Она равна содержанию растворенного вещества в его насыщенном растворе при данной температуре. Растворимость зависит от природы веществ и термодинамических параметров системы. Влияние природы веществ на растворимость описывается правилом: «Подобное растворяется в подобном». Другими словами, полярные вещества хорошо растворяются в полярных растворителях, а неполярные — в неполярных. Например: поваренная соль NaCl хорошо растворима в воде и плохо в бензоле; I2 хорошо растворим в бензоле и плохо в воде. Растворение газов в воде можно представить схемой: А(газ) + Н2О В соответствии с принципом Ле Шателье при повышении температуры равновесие смещается влево, т.е. растворимость уменьшается, а при понижении температуры — вправо, растворимость увеличивается (таблица 3).
Таблица 3 — Растворимость газов (л/1л Н2О) при р = 1 атм.
В соответствии с принципом Ле Шателье при увеличении давления равновесие смещается вправо, т.е. растворимость газов растет. Количественная зависимость растворимости газа от давления описывается уравнением Генри (1803 г.): S = k·p, где k — константа Генри, p — давление газа над раствором. Закон Генри позволяет вскрыть причины возникновения кессонной болезни. Она возникает у водолазов, летчиков и представителей других профессий, которые по роду деятельности быстро переходят из среды с высоким давлением в среду с низким давлением. В период пребывания человека в среде с высоким давлением его кровь и ткани насыщаются азотом (N2) и частично углекислым газом (СО2). Накопления кислорода не происходит, так как он расходуется на физиологические процессы в организме. При быстром переходе человека в среду с низким давлением происходит выделение избыточных количеств растворенных газов, которые не успевают диффундировать через легкие и образуют газовые пробки в тканях и кровеносных сосудах. Это приводит к закупорке и разрыву кровеносных капилляров, накоплению пузырьков газа в подкожной жировой клетчатке, в суставах, в костном мозге. Симптомами кессонной болезни являются головокружение, зуд, мышечные и загрудинные боли, нарушение дыхания, паралич и смерть. На растворимость газов влияет присутствие электролитов в растворе. Эта зависимость описывается уравнением Сеченова (1859 г.): S = So·e-kc где S и So — растворимость газа в растворе электролита и чистой воде, с — концентрация электролита, k — константа Сеченова. Из уравнения Сеченова следует, что чем выше концентрация электролита в растворе, тем ниже растворимость газов. Вот почему растворимость газов в воде больше, чем в плазме (таблица 4).
Таблица 4 — Растворимость газов в чистой воде и плазме крови при 38ºС
Растворение жидкости в воде можно представить схемой: А (ж) + Н2О Основной стадией растворения жидкости в жидкости является диффузия, скорость которой возрастает с увеличением температуры. Соответственно, взаимная растворимость жидкостей усиливается с ростом температуры. Различают три типа жидкостей: а) неограниченно растворимые друг в друге: Н2SO4 / Н2О, С2Н5ОН / Н2О; б) ограниченно растворимые: С6Н6 / Н2О в) абсолютно нерастворимые: Hg / H2O. Если в систему из двух несмешивающихся жидкостей добавить третий компонент, то отношение его концентраций в каждой жидкости есть величина постоянная при данной температуре (закон распределения Нернста-Шилова) (рисунок 6).
Рисунок 6 — Закон распределения Нернста-Шилова Закон Нернста-Шилова – теоретическая основа экстракции, одного из способов разделения смесей.
Растворение твердых веществ в воде описывается схемой: А (к) + Н2О Если растворяется труднорастворимый электролит (соль, основание или кислота), то гетерогенное равновесие между твердым веществом и его ионами в насыщенном растворе можно представить схемой: AnBm (к) Данное равновесие характеризуется при помощи константы растворимости Ks, являющейся константой гетерогенного равновесия: Ks = [A+]n · [B-]m Для бинарных электролитов n = m = 1, следовательно Ks = [A+] · [B-]. Соответственно S2 =Кs, и S = Например, при растворении труднорастворимой соли BaSO4 в воде устанавливается гетерогенное равновесие между кристаллами вещества и его ионами в насыщенном растворе: BaSO4 (к) Согласно закону действующих масс, KS = [Ba 2+] [SO42-] = 1,1·10-10. Отсюда S = Чем меньше Ks, тем ниже растворимость вещества и легче формируется осадок труднорастворимого электролита. Условие образования осадка труднорастворимого электролита можно сформулировать следующим образом: осадок выпадает из насыщенных и пересыщенных растворов. В насыщенном растворе [A+]·[B-] = Ks, а в пересыщенном растворе [A+]·[B-] > Ks Одним из наиболее важных гетерогенных процессов in vivo является образование костной ткани. Основным минеральным компонентом костной ткани является кальций гидроксофосфат (гидроксоаппатит) Са5(РО4)3ОН. Процесс формирование костной ткани можно представить следующим образом. В крови при рН = 7,4 в приблизительно равных количествах находятся анионы НРО42– и Н2РО4–, а также катионы Са2+. После сравнения констант растворимости CаНРО4 (КS = 2,7∙10–7) и Cа(Н2РО4)2 (КS = 1∙10–3), становится очевидным, что менее растворимой является соль СаНРО4. Вследствие этого, именно СаНРО4 образуется на первой стадии формирования костной ткани: Са 2+ + НРО42– Дальнейшее формирование гидроксоаппатита протекает в соответствии с уравнениями: 3 СаНРО4 + Са2+ + 2 ОН– Са4Н(РО4)3 + Са2+ + 2 ОН– Константа растворимости гидроксоаппатита очень мала (КS = 10-58), что свидетельствует о высокой устойчивости костной ткани. При избытке ионов Са2+ в крови равновесие сдвигается вправо, что приводит к обызвествлению костей. При недостатке Са2+ равновесие сдвигается влево; происходит разрушение костной ткани. У детей это приводит к рахиту, у взрослых развивается остеопороз. При недостатке кальция в костной ткани его место могут занять ближайшие электронные аналоги: бериллий и стронций. Их накопление вызывает соответственно бериллиевый и стронциевый рахит (повышенная ломкость и хрупкость костей). При инкорпорации радиоизотопа Sr-90 в костную ткань происходит облучение костного мозга, что может привести к лейкозу и другим онкологическим заболеваниям. Кальций блокирует накопление организмом радиоактивного стронция.
Лекция 5
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1717; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.201.101 (0.007 с.) |

 А(раствор), DрН<О
А(раствор), DрН<О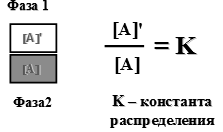

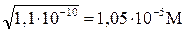 .
.


