Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисление растворимости по константе растворимости.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
План решения: 1. Выразить растворимость через Х моль/л. 2. Написать уравнение диссоциации малорастворимого сильного электролита. Определить концентрации ионов в растворе по уравнению. 3. Записать формулу для константы растворимости данного малорастворимого сильного электролита. 4. Выразить из этой формулы значение для х (растворимость в моль/л). 5. Вычислить значение растворимости.
Задача 3. Произведение растворимости равно 1,0.10-97. Вычислите растворимость сульфида висмута в молях и в граммах на литр насыщенного раствора.
2). KS = [Bi3+]2 · [S2-]3 3). KS = (2х)2 · (3х)3= 108х5, 4). х =. 5) х = М (Bi2S3) = 691 г/моль. S (Bi2S3) = 1,56 · 10-20 х 691 = 1,1 · 10-17 г/л. **Вычисление константы растворимости по растворимости вещества. План решения: 1. Выразить растворимость в моль/л, если по условию она приведена в других единицах. 2. Написать уравнение диссоциации малорастворимого сильного электролита. Выразить растворимость через Х моль/л. Определить концентрации ионов в растворе по уравнению. 3. Записать формулу для константы растворимости данного малорастворимого сильного электролита. 4. Подставить в формулу для KS значения концентраций ионов, выраженные через Х. 5. Вычислить значение константы растворимости. Задача 4. В 1000 мл насыщенного водного раствора, полученного при 250С, содержится 8,8.10-7 г бромида серебра. Вычислите произведение растворимости бромида серебра.
3). KS = [Ag+] · [Br-] 4). KS = х · х = х2 5) KS = (4,7 · 10-9)2 = 2,2 · 10-17. Алгоритм решения задачи №5***(приведены два способа вычисления моляльной концентрации). Запишите данные задачи, переведите необходимые значения в единицы СИ. 2. Запишите математическую формулу следствия закона Рауля для растворов неэлектролитов ΔТзам.= К·b(Х), К=1,86 кг × К × моль-1 и Тзам. = Т0зам. - ΔТзам., Вычислите моляльную концентрацию раствора (п. 4 - 9 или 4 - 8).
10 или 9. Решить задачу.
Лабораторная работа №:5. Ионные равновесия и реакции в растворах электролитов. Образование и растворение осадков. Ионные реакции Опыт 1. а) В 2 пробирки возьмите пипеткой по 5 капель растворов, содержащих сульфат ионы, и в каждую добавьте по 2 капли раствора соли бария, что наблюдается? Напишите молекулярные и ионные уравнения реакций. Реактивом на какой ион служит ион бария? б) В одну пробирку возьмите 5 капель раствора соли Fe(II), во вторую 5 капель раствора соли Cu(II). В каждую добавьте по 2-3 капли раствора, содержащего сульфид-ионы. Что наблюдается? Напишите молекулярные и ионные уравнения реакций, (продукты реакций сохраните для следующего опыта). Растворение осадков. Опыт 2. К осадкам железо(II) сульфида и медь(II) сульфида, полученным в опыте №1 (б) (предварительно слить с осадков раствор), прибавьте 8-10 капель раствора соляной кислоты. Оба ли осадка растворились? Оформите протокол лабораторной работы Наблюдения заносятся в лабораторный журнал по мере выполнения лабораторной работы. Образец оформления лабораторной работы. Выполнить до занятия. Оформление работы следует делать на развороте тетради, с новой страницы. Описание эксперимента и наблюдения оформляют в виде таблицы. Графу наблюдения заполнить дома: нарисовать по две пробирки для каждого опыта (исходные вещества и продукты реакции), после выполнения эксперимента отметить признаки протекающих реакций (на рисунке и словесно).
Таблица заполняется на занятии.
Задание к занятию №6 I. Теория. Учение о растворах(разделы 3.6 – 3.8 программы). Повторить (разделы 3.1 – 3.5 программы).
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 3081; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.7.116 (0.007 с.) |


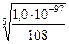 = 1,56 · 10-20. S (Bi2S3) = 1,56 · 10-20 моль/л.
= 1,56 · 10-20. S (Bi2S3) = 1,56 · 10-20 моль/л.
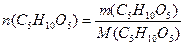 8. Вычислить массу воды: m(H2O) = m(р-ра) - m(C5H10O5)
9. Вычислить моляльную концентрацию:
8. Вычислить массу воды: m(H2O) = m(р-ра) - m(C5H10O5)
9. Вычислить моляльную концентрацию: 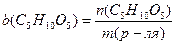 , моль/кг
, моль/кг