
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II. Решить упражнения и задачи.Содержание книги
Поиск на нашем сайте
1. Рассчитайте растворимость (S) кальция фторида в воде. Кs = 4 × 10-11. 2. *. Рассчитайте рН раствора калия гидроксида с молярной концентрацией 0,005 моль/л. 3. **Рассчитайте степень ионизации и концентрацию ионов водорода, рН и рОН в 0,2 моль/л растворе уксусной кислоты. Кa = 1,75 ×10-5. 4. **. Рассчитайте степень ионизации, концентрацию гидроксид ионов и ионов водорода, рН и рОН в растворе аммиака с концентрацией 0,1 моль/л. Кb = 1,8 × 10-5 моль/л. 5. Написать уравнения реакций гидролиза солей: а) указанных в лабораторном задании, б) цианида натрия, карбоната калия, фосфата натрия, хлорида аммония, нитрата меди (II), цианида аммония, сульфида аммония, сульфида хрома (III). Для солей, подвергающихся многоступенчатому гидролизу, написать уравнения реакций гидролиза по первой ступени. 6. ***Вычислить ионную силу раствора, содержащего в 750 мл 17,4 г калия сульфата и 4,75 г магния хлорида. III. Лабораторная работа. IV. Решить «0» вариант самостоятельной работы №3 (в тетради для «0» -х вариантов).
Приложение к п.II. Задача 1*. Вычислите рН раствора, в котором концентрация ионов Н+ (моль/л) равна 5,6 · 10-7 моль/л.
Задача 2*. Вычислите рН раствора, в котором концентрация ионов ОН- (моль/л) равна 6,3 · 10-6.
Решение: Задача 3**. Определите степень ионизации, концентрацию ионов водорода, рН в 1 М растворе уксусной кислоты, если константа диссоциации ее 1,754 . 10-5. (1 М раствор – раствор с молярной концентрацией 1 моль/л).
Задача № 4. Вычислить ионную силу раствора, содержащего 51,3 г сульфата алюминия в 750 мл раствора.
2) Найти I. 1-ый способ вычисления Al2(SO4)3 = 2 Al3+ + 3 SO42- С (Al3+) = 0,4 моль/л; Z = 3 С(SO42-) = 0,6 моль/л, Z = 2
2-ой способ вычисления Для данной соли (из пяти ионов): I = 15C0 = 15 х 0,2 =3 моль/л. Ответ: 3 моль/л
Лабораторная работа. Равновесия в водных растворах электролитов. Опыт 1. Гидролиз солей. На предметном стекле положите четыре кусочка универсальной индикаторной бумаги (1/4 часть полоски). Нанесите на первую бумагу 1каплю раствора соли Na2СO3; на вторую – Al2(SO4)3; на третью - CH3COONH4, на четвертую - NaCl. Определите рН растворов. Какие соли подвергаются гидролизу? По каким ионам происходит гидролиз этих солей? Составьте уравнения реакций гидролиза в ионном виде, в протолитической форме. Опыт 2.. Амфотерные электролиты. В пробирку налейте 1 мл раствора Al2(SO4)3 и по каплям приливайте к нему раствор щелочи до выпадения аморфного осадка. Раствор с осадком разделите на две пробирки. В одну пробирку прилейте избыток щелочи, в другую – сильной кислоты. Что наблюдается? Напишите уравнения всех реакций в ионном виде, в протолитической форме. Сделайте вывод о растворимости амфотерных гидроксидов в сильных кислотах и щелочах. Оформите протокол лабораторной работы Наблюдения заносятся в лабораторный журнал по мере выполнения лабораторной работы. Образец оформления лабораторной работы. Выполнить до занятия. Оформление работы следует делать на развороте тетради. Описание эксперимента и наблюдения оформляют в виде таблицы.
Самостоятельная работа № 3. Учение о растворах Вариант №0 1. Константа равновесия процесса
2. В каком направлении сместится равновесие, указанное, указанное в п.2, если в систему ввести некоторое количество натрия тетрабората
3. Какой из растворов имеет максимальное осмотическое давление?
4. рН раствора, в 1 л которого содержится 0,365 г HСl равен: а) 1 б) 2 в) 3 г) 7 д) 11 е) 12 5. Чему равно осмотическое давление раствора, содержащего в 0,5 л 0,05 моль глюкозы при 0°С?
6. Укажите в каком из растворов
7. Напишите в ионной форме уравнения реакции гидролиза алюминия сульфата и укажите реакцию среды. а) щелочная б) нейтральная в) кислая г) сильно щелочная 8. Равновесная концентрация ионов свинца в насыщенном растворе свинца сульфата равна 1,26·10-4 моль/л. Вычислите константу растворимости свинца сульфата. а) 0,8 . 10-8 моль2/л2 б) 1,59 . 10-8 моль2/л2 в) 3,2 . 10-8 моль2/л2 г) 0,159 . 10-6 моль2/л2 9. Выпадет ли осадок при сливании 40мл 0,002 моль/л раствора нитрата свинца и 60 мл 0,001 моль/л раствора фторида натрия. Кs(PbF2) = 2,7 ∙ 10-8.
Задание к занятию №7 Контрольная работа №2 I. Повторить раздел 3 программы. II. Решить «0» вариант контрольной работы №2 (в тетради для «0»-х вариантов).
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-13; просмотров: 780; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.237.68 (0.007 с.) |

 , pOH = - lg [OH-] = - lg 1,58 · 10-10 = 9,8.
Ответ: рН = 9,8
, pOH = - lg [OH-] = - lg 1,58 · 10-10 = 9,8.
Ответ: рН = 9,8
 =
=  =4∙10-3=0,004 (0,4%).
б) концентрация ионов водорода:
1 способ:
=4∙10-3=0,004 (0,4%).
б) концентрация ионов водорода:
1 способ:  =
=  = 0,004 моль/л.
2 способ: [H+] = α × Со = 0,004 × 1 = 0,004 моль/л.
Для слабых электролитов α → 0, т.е. 1 – α → 1
в) pH = - lg [H+]; pH = - lg 0,004 = 2,4.
Ответ: α = 0,4%; H+] = 0,004 моль/л; pH = 2,4.
= 0,004 моль/л.
2 способ: [H+] = α × Со = 0,004 × 1 = 0,004 моль/л.
Для слабых электролитов α → 0, т.е. 1 – α → 1
в) pH = - lg [H+]; pH = - lg 0,004 = 2,4.
Ответ: α = 0,4%; H+] = 0,004 моль/л; pH = 2,4.
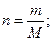

 ;
; 
 ; I = ½ [С (Al3+) · 32 + С (SO42-) · 22] = ½ (0,4 · 32 + 0,6 · 22) = ½ · 6 = 3 моль/л.
; I = ½ [С (Al3+) · 32 + С (SO42-) · 22] = ½ (0,4 · 32 + 0,6 · 22) = ½ · 6 = 3 моль/л.







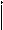


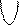
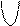


 +
+  равна 2,0 ×10
равна 2,0 ×10  моль/л. Рассчитать равновесную концентрацию иона
моль/л. Рассчитать равновесную концентрацию иона  (моль/л), если равновесная концентрация
(моль/л), если равновесная концентрация  = 0,1 моль/л
= 0,1 моль/л


 ?
?

 возможен гемолиз эритроцитов?
возможен гемолиз эритроцитов?






