
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Произведение растворимости (ПР)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Рассмотрим процессы, возникающие при взаимодействии твердого вещества KtnAnm ионного типа с водой. Под действием растворителя ионы Ktm+ и Аnn- будут переходить в жидкую фазу и одновременно, за счет электростатического притяжения, часть пере-шедших в раствор ионов вновь будет осаждаться на твердой фазе. Спустя некоторое время в системе установится равновесие, кинети-ческим условием которого является равенство скоростей процессов растворения и осаждения, а термодинамическим - постоянство свободной энергии Гиббса (DG = 0). Раствор, находящийся в равновесии с твердой фазой, называют насыщенным. Иными словами, насыщенный раствор - это раствор, в котором при данной температуре содержится максимально возможное количество растворенного вещества. Если количество растворенного вещества меньше максимально возможного, раствор называется ненасыщенным, если больше - пересыщенным. Мерой растворимости вещества при данных условиях служит концентрация его насыщенного раствора. Поэтому численно раство-римость может быть выражена тем же способом, что и концентрация: например, в процентном содержании растворенного вещества в насы-щенном растворе или количеством растворенного вещества, содер-жащимся в 1 л насыщенного раствора. Нередко используют понятие коэффициент растворимости, ко-торый выражается массой вещества, способной раствориться в 100 г растворителя при данной температуре. Для малорастворимых соединений чаще всего используют молярную концентрацию насыщенного раствора, которую называют растворимостью вещества Р. Растворимость твердых веществ зависит от природы растворенного вещества и растворителя, а также от состава раствора и температуры. Растворимость газов зависит, главным образом, от состава раствора и парциального давления. Влияние природы компонентов раствора выражается простым правилом: подобное растворяется в подобном, т.е. растворенные вещества с ионными или сильно полярными ковалентными связями лучше растворяются в полярных растворителях (например, воде), а вещества с малополярными или неполярными связями - в неполяр-ных растворителях (например, гексане). Растворимость твердых тел, как правило, увеличивается с повы-шением температуры и мало зависит от давления. Для газов характер-на противоположная зависимость: с ростом температуры их раство-римость уменьшается, а при повышении давления - увеличивается. В водных растворах растворенная часть вещества-электролита, в большинстве случаев, полностью диссоциирует на ионы. Поэтому в системе твердое вещество – насыщенный раствор устанавливается равновесие между осадком и ионами, образовавшимися при диссоциации растворенной части вещества:
Применив к этому равновесию закон действующих масс, получим выражение для константы равновесия:
При постоянной температуре количество осадка в системе с течением времени не изменяется, и при данных условиях концен-трация твердой фазы является величиной постоянной. Соответст-венно, произведение константы равновесия на концентрацию твердой фазы также будет величиной постоянной:
Следовательно:
Таким образом: В насыщенном растворе малорастворимого сильного электро-лита при данной температуре произведение молярных концентраций его ионов, возведенных в степени их стехиометрических коэффици-ентов, есть величина постоянная и называется произведением растворимости. Произведение растворимости ПР (или
В этой формуле m и n – число анионов и катионов в формуле вещества. Величина ПР зависит от природы электролита, растворителя и температуры. С ростом температуры ПР обычно увеличивается, так как при нагревании раствора для большинства твердых веществ характерно увеличение растворимости. В медицинской практике наибольший интерес вызывают водные растворы электролитов, поэтому в рамках данной темы другие растворители использоваться не будут. Пример 1. Написать выражения для ПP следующих солей: AgCl, BaSO4, PbCl2, Ca3(PO4)2. Решение.
Приведенные уравнения, написанные на основе классической теории электролитической диссоциации, не вполне точны, так как в них не учтено влияние на растворимость электролита электростати-ческих сил, действующих между ионами. Если учесть это влияние, т. е. вместо концентраций Ktm+ и Аnn- в уравнение (1) подставить их активности в насыщенном растворе, то величина произведения растворимости несколько уменьшится. Однако, в большинстве случаев, насыщенные растворы малораст-воримых электролитов являются очень разбавленными и их ионная сила близка к нулю (так, ионная сила насыщенного раствора BaSO4 имеет порядок 10-5). В таких случаях различия между концентрацией и активностью ионов можно не принимать во внимание. К хорошо растворимым электролитам правило произведения рас-творимости неприменимо. Величину ПР можно использовать только в отношении электролитов, растворимость которых в воде не пре-вышает 0,01 моль/л. Численные значения произведения растворимо-сти различных малорастворимых электролитов указаны в таблице 1. Поскольку растворенная часть сильного электролита полностью распадается на ионы по уравнению KtnAnm то при растворимости вещества Р концентрация катионов составит nР, а концентрация анионов - mР. Тогда:
Следовательно:
где n, m - стехиометрические коэффициенты т.е. число катионов и анионов). Полученное выражение позволяет рассчитывать концентрацию насыщенного раствора вещества (растворимость) Р (в моль/л) по величине его произведения растворимости ПР. В некоторых случаях растворимость выражают в г/л. Пересчет можно выполнить при помощи соотношения:
где M - молярная масса электролита. Пример 2. Написать выражения, связывающие Р (моль/л) и ПP малорастворимых электролитов: AgI, CaF2, Al(OH)3 Mg3(PO4)2. Решение.
Пример 3. Определить, какая из солей является болеераствори-мой: CaSO4 или BaCO3, если Решение. Растворимость данных солей связана с ПР по одному и тому же уравнению: Пример 4. Сравнить растворимостьсолей: AgCl и Ag2CrO4, если Решение. В данном случае сравнение величин ПР недопустимо, так как соли неоднотипны. Действительно:
Таким образом, более растворимой солью является хромат серебра, тогда как сравнение величин ПР приводит к обратному заключению. Таблица 1. Произведения растворимости некоторых малорастворимых солей и гидроксидов в водных растворах
Условия образования и растворения осадка 1. Термодинамика процесса образования осадка. При любом произвольном соотношении компонентов «твердый осадок - раствор» система будет стремится к состоянию равновесия:
Этот процесс можно описать при помощи изотермы Вант-Гоффа:
В насыщенном растворе:
и DG = 0. В ненасыщенном или пересыщенном растворе величина Из уравнения изотермы Вант-Гоффа видно, что если В другом случае, если Таким образом, зная концентрации ионов в растворе, можно прогнозировать направление смещения гетерогенного равновесия: 1) Условие выпадения осадка: Если произведение концентраций ионов, возведенных в степени их стехиометрических коэффициентов, превышает произведение растворимости, то происходит образование твердой фазы (осадка):
2) Условие растворения осадка: Если произведение концентраций ионов, возведенных в степени стехиометрических коэффициентов, не превышает произведение растворимости, то осадок не образуется, а при наличии в системе твердой фазы (осадка) происходит ее растворение:
Следует отметить, что для растворения осадка достаточно умень-шить концентрацию одного из ионов. Этого можно достичь, например, добавляя реагент, связывающий ион малорастворимого электролита в растворимое малодиссоциирующее соединение или газообразное вещество. 2. Кинетика процесса образования осадка. Процесс образования твердой фазы (осадка) можно рассмат-ривать как двухстадийный: 1 стадия ‑ химическое взаимодействие, т. е. обменная реакция между ионами; 2 стадия ‑кристаллизация, т. е. образование зародышей кристал-лизации и их рост. Первая стадия протекает с довольно высокой скоростью, вторая - значительно медленнее. Это обстоятельство объясняет тот факт, что при достижении условия выпадения осадка последний не всегда образуется момен-тально. Он может появиться через несколько часов, а то и суток. В целом, кинетика процесса образования осадка довольно сложна и в рамках данного пособия подробно не рассматривается.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2478; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.209.144 (0.009 с.) |

 .
.

 ) количественно харак-теризует растворимость данного вещества при данной температуре.
) количественно харак-теризует растворимость данного вещества при данной температуре. .
.




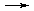 nKtm+ + mAnn-,
nKtm+ + mAnn-,
 ,
,

 ;
; ;
; ;
; .
.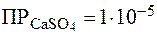 ,
,  .
. . В этом смысле соли являются однотипными и для сравнения их растворимости достаточно сопоставить величины их ПР. Очевидно, что
. В этом смысле соли являются однотипными и для сравнения их растворимости достаточно сопоставить величины их ПР. Очевидно, что  >
>  , следовательно, сульфат кальция более растворим.
, следовательно, сульфат кальция более растворим. ,
,  .
.



 называется произведение концентраций ионов и обозначается
называется произведение концентраций ионов и обозначается 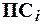 .
. (пересыщенный раствор), то DG > 0 и, следовательно, процесс самопроизвольно протекает в обратном направлении, т.е. в сторону образования твердой фазы.
(пересыщенный раствор), то DG > 0 и, следовательно, процесс самопроизвольно протекает в обратном направлении, т.е. в сторону образования твердой фазы. (ненасыщенный раствор), то DG < 0 и процесс самопроизвольно протекает в прямом направлении, т.е. в сторону растворения осадка.
(ненасыщенный раствор), то DG < 0 и процесс самопроизвольно протекает в прямом направлении, т.е. в сторону растворения осадка. .
. .
.


