
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическое значение осмотического давленияСодержание книги
Поиск на нашем сайте
Осмос играет большую роль в существовании растительных и животных организмов, способствуя достаточному наполнению водой клеток и межклеточных структур. Животные и растительные клетки в составе своей оболочки имеют полупроницаемые мембраны и могут рассматриваться как миниатюрные осмотические системы. Так, оболочка эритроцитов непроницаема для ряда катионов (например, для К+, Na+) и свободно пропускает анионы и воду. Возникающее при этом осмотическое давление обуславливает тургор клеток (от лат. turgor - вздутие, наполнение), т. е. внутреннее гидростатическое давление в живой клетке, вызывающее напряжение клеточной оболочки. У животных тургор клеток обычно невысок, а у растений варьируется от 5-20 атм до 120-140 атм (у растений засушливых районов). Более высокое (по сравнению с грунтовыми водами) осмотическое давление клеток растений обеспечивает процесс всасывания воды корнями растений и дальнейший ее подъем на значительную высоту. Тургорным действием объясняется также набухание семян растений, явление «пробивания» растущими побегами земли и других препятствий, поддержание листьев и стеблей (у травянистых растений) в вертикальном положении. Наличие воды в клетках и тканях необходимо и для протекания многообразных физических и химических процессов: гидратации и диссоциации веществ, реакций гидролиза, окисления и т. п. Иначе говоря, тургор - это показатель состояния водного режима клеток. Снижение тургора приводит к старению и увяданию клеток. Растворы с равным осмотическим давлением, называются изотоническими. Если два раствора имеют различное осмотическое давление, то раствор с большим давлением называются гипертони-ческим, с меньшим давлением - гипотоническими. Пример 2. Не прибегая к расчетам, указать, какие из растворов при одинаковой температуре являются изотоническими: а) С(NaCl) = 0,03 моль/л, a = 1 и С(С6Н12О6) = 0,03 моль/л; б) С(CO(NH2)2) = 0,03 моль/л и С(СаС12) = 0,01 моль/л, Решение. Для растворов электролитов:
для неэлектролитов i = l, следовательно:
Для каждой пары растворов RT = const, следовательно, достаточно сравнить множитель i ×С(x) в каждой паре растворов. а) 2×0,3 ¹ 0,3 (неизотоничны); б) 0,3 = 3×0,1 (изотоничны). Очевидно, что изотонические растворы содержат одинаковое ко-личество осмотически активных частиц. Активную концентрацию частиц, не проникающих через идеальную полупроницаемую мембра-ну, выражают через осмолярность (осмоляльность). Осмолярностью (осмоляльностью) раствора называется суммарная концентрация всех кинетически активных частиц в растворе, определяющих его осмотическое давление. Математически величины осмолярности и осмоляльности рассчитываются следующим образом:
Единицы измерения этих величин совпадают с единицами измерения молярной и моляльной концентрации, соответственно. В медицинской литературе эти величины принято выражать в Осмоль/л и Осмоль/кг. В разбавленных водных растворах осмолярность и осмоляльность приблизительно равны. Пример 3. Рассчитать осмолярность клеток саксаула, если осмотическое давление при 300С равно 145 атм. Решение. Осмолярность раствора определим по формуле:
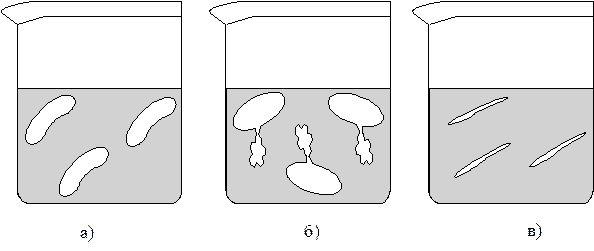
Если поместить животные или растительные клетки в гипотони-ческий раствор, то произойдет перемещение воды внутрь клеток, что приведет к их набуханию, а затем, возможно, к разрыву оболочек и вытеканию клеточного содержимого (рис. 3.). Подобное разрушение клеток называется лизисом, а в случае эритроцитов - гемолизом. В гипертонических растворах происходит сморщивание клеток (плазмолиз), обусловленное потерей воды, перемещающейся из них во внешний раствор.
Рис. 3. Изменения, происходящие с кровяными тельцами в растворах NaCl различной концентрации: а – изотонический раствор NaCl (0,9%); б – гипотонический раствор NaCl (0,1%); в – гипертонический раствор NaCl (2%). Пример 3. Что произойдет с растительной клеткой, осмотическое давление внутри которой pкл составляет 20 атм, если ее поместить в раствор с pр-ра = 30 атм? Решение. Так как p(р-ра) > p(клетки), следовательно, раствор гипер-тонический. Наблюдается сморщивание (плазмолиз) клетки за счет перемещения воды из клетки в раствор. Осмотическое давление биологических жидкостей, отвечающее состоянию тургора, у разных живых организмов неодинаково. Так, некоторые морские животные имеют осмотическое давление крови выше, чем у человека. Это связано с обитанием этих животных в среде с высоким содержанием солей. Обитатели же пресноводных водоемов, например, лягушки, имеют осмотическое давление крови ниже, чем у человека. Биологические жидкости человека - тканевые жидкости, кровь, лимфа, - представляют собой водные растворы низкомолекулярных соединений (NaCl, KCl, CaCl2), высокомолекулярных соединений (белков, полисахаридов, нуклеиновых кислот) и форменных элементов (в крови - это эритроциты, лейкоциты, тромбоциты). Их суммарное осмотическое давление определяет тургор клеток. Так, осмотическое давление кровяных эритроцитов человека составляет 7,6-7,9 атм. Такое же осмотическое давление создает и 0,9%-й (С(NaCl) = 0,15 моль/л) раствор NaCl (физиологический раствор), являющийся, следовательно, изотоничным крови. Существенную часть крови составляют белки, представленные в основном дыхательными пигментами, белками стромы эритроцитов и белками других форменных элементов. Белки, растворённые в плазме (6,5-8,5% из 9-10% сухого остатка плазмы), образуются преимущест-венно в клетках печени и ретикулоэндотелиальной системы. Белки плазмы крови не проникают через стенки капилляров, поэтому содер-жание их в плазме значительно выше, чем в тканевой жидкости. Это приводит к удержанию воды белками плазмы. Часть осмотического давления крови, создаваемая белками (альбумины, глобулины), называется онкотическим давлением. Онкотическое давление равно 0,04 атм, что составляет прибли-зительно 0,5% от общего осмотического давления крови. Несмотря на то, что онкотическое давление составляет лишь небольшую часть общего осмотического давления крови, именно оно обуславливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. При иных условиях в результате высокого гидродинамического давления в кровеносной системе вода просачивалась бы в ткани, что вызывало бы возник-новение отёков различных органов и подкожной клетчатки. Падение осмотического давления в клетках при обезвоживании организма приводит к их коллапсу (плазмолизу); наоборот, обес-соливание организма приводит к набуханию и разрыву клеток (осмотический шок). Шок при сильных кровотечениях обусловлен не столько потерей крови, сколько резким падением осмотического давления и коллапсом сосудов. Поэтому при больших потерях крови пострадавшим вводят инертные высокомолекулярные заменители плазмы крови (например, раствор поливинилпирролидона), благодаря которым восстанавливается тургор и устраняется шок. Эталоны решения задач Примечание. При расчете Dtкр. и Dtкип. следует помнить, что 10 по шкале Цельсия равен 10 по шкале Кельвина, поэтому любая конечная разность температур может быть представлена как в 0C, так и в К без соответствующего пересчета. 1. Вычислить температуру кипения и температуру кристал-лизации водного раствора мочевины, содержащего 6 г CO(NH2)2 в 100 г воды, если К(H2O) = 1,86 К×кг/моль, E(H2O) = 0,52 К×кг/моль. Решение.
Известно, что:
Для раствора неэлектролита:
Моляльная концентрация раствора равна:
Таким образом:
2. Вычислить температуру кипения и температуру кристал-лизации 10% раствора сульфата натрия, если Решение. Для раствора электролита:
Если массовая доля раствора равна 10%, то это означает, что в 100 г раствора содержится 10 г вещества и 90 г воды. Тогда:
Изотонический коэффициент рассчитаем по формуле (10):
Таким образом:
3. При растворении 0,029 моль неэлектролита в 100 г ацетона температура кипения раствора повысилась на 0,4350С. Вычислить эбулиоскопическую константу ацетона. Решение. Согласно следствию из закона Рауля:
Отсюда:
4. В равных объемах эфира растворены одинаковые массы бензойной кислоты (C6H5COOH) и анилина (C6H5NH2). Определить, какой из растворов кипит при более высокой температуре. Решение. Согласно следствию из закона Рауля:
Разделим одно выражение на другое и получим:
Таким образом, 5. Найти массу фенола C6H5OH, которую необходимо растворить в 200 мл бензола, чтобы снизить температуру кристаллизации раствора до 50C, если для бензола: r = 0,87 г/мл, К = 5,1 К×кг/моль, Решение. Согласно следствию из закона Рауля:
Массу растворителя найдем из соотношения:
Отсюда:
6. Определить, что произойдет с растительной клеткой, осмоти-ческое давление внутри которой 5 атм, если ее поместить в раствор глюкозы c w(С6Н12О6) = 1,8% плотностью 1 г/мл при 170С. Решение. Согласно закону Вант-Гоффа, осмотическое давление раствора p пропорционально молярной концентрации раствора. Поэтому следует выразить концентрацию раствора в моль/л:
Так как глюкоза является неэлектролитом, осмотическое давление раствора находим по формуле (6):
Так как p(раствора) < p(клетки), следовательно, раствор глюкозы является гипотоническим по отношению к клетке и будет проис-ходить набухание клетки. 7. Найти молярную концентрацию раствора неэлектролита, если осмотическое давление этого раствора при 170С равно 482 кПа. Решение. В растворе неэлектролита С(x) найдем, используя формулу (6):
8. Определить, как и во сколько раз изменится осмотическое давление раствора неэлектролита, если температуру раствора повы-сить от 17 до 470С (изменением объема при нагревании пренебречь). Решение. Согласно закону Вант-Гоффа, осмотическое давление раствора p увеличивается с ростом температуры. При условии равенства концен-траций можно записать:
Отсюда:
Таким образом, осмотическое давление увеличилось в 1,14 раз. 9. Найти, в каком объемном соотношении следует развести раствор с осмотическим давлением 1,6 МПа водой, чтобы снизить осмотическое давление раствора до 0,4 МПа. Решение. Так как T и R = const:
При разведении раствора: V2 = V1 + V(H2O). Отсюда: V(H2O) = 4×V1 - V1 = 3×V1. Таким образом, раствор следует развести водой в объемном соотношении 1:3. 10. Рассчитать осмотическое давление водного раствора глюкозы при 170С, если понижение температуры кристаллизации этого раствора составляет 0,3720. Решение. Глюкоза - неэлектролит, поэтому:
Учитывая, что для разбавленных водных растворов b(х)» С(х), из второго уравнения выразим b(х) и подставим в первое:
11. Температура кипения раствора, содержащего 0,4 г серы в 50 г бензола, на 0,080С выше температуры кипения чистого бензола. Уста-новить молекулярную формулу серы, если Е(C6H6) = 2,56 К×кг/моль. Решение. Обозначим молекулу серы Sn и запишем соответствующее следствие из закона Рауля:
Отсюда:
Таким образом, молекула серы имеет формулу S8. 12. Определить молярную массу поливинилпирролидона (ПВП), применяемого в качестве заменителя плазмы крови, если при 200С осмотическое давление раствора, содержащего 1 г ПВП в 100 мл воды составляет 20 мм. рт. ст. Решение. Выразим объем раствора в л, а осмотическое давление в кПа:
Согласно закону Вант-Гоффа:
Отсюда:
13. Вычислить изотонический коэффициент для раствора электролита с молярной концентрацией 0,001 моль/л, если в 500 мл этого раствора содержится 3,4×1020 частиц (молекул и ионов) растворенного вещества. Решение. Изотонический коэффициент показывает, во сколько раз возрастает число активных частиц при диссоциации растворенного вещества: i = N/N0. Для приготовления 500 мл раствора был взят электролит, число молекул которого N0 равно:
Таким образом:
14. Раствор, содержащий 0,85 г ZnCl2 в 125 г воды, кристалли-зуется при -0,230С. Вычислить кажущуюся степень диссоциации Решение. В растворе электролита кажущуюся степень диссоциации
Определим
Найдем b(х) соли в растворе:
Отсюда:
Таким образом:
15. Рассчитать температуру кристаллизации и осмотическое давление раствора молочной кислоты с концентрацией 0,02 моль/л при 350С, если Решение. В растворе слабой одноосновной кислоты степень диссоциации можно рассчитать по закону Оствальда*:
Изотонический коэффициент найдем по уравнению (10):
Осмотическое давление раствора рассчитаем по формуле (9):
Относительное понижение температуры кристаллизации найдем по уравнению (7), учитывая, что b(х)» С(х):
Отсюда:
*Молочная кислота - электролит средней силы, поэтому более точный расчет величины a следует проводить по уравнению:
Решая квадратное уравнение:
получим: a» 0,07. 16. 1 л инкубационного раствора, идентичного по составу влаге передней стенки глаза, содержит 104,32 ммоль NаCl, 27,26 ммоль NaHCO3, 4,08 ммоль KHCO3, 0,79 ммоль MgCl2, 1,77 ммоль глюко-ната кальция, 5,55 ммоль глюкозы; 0,59 ммоль K2SO4, 0,56 ммоль аскорбиновой кислоты ( Решение. Осмолярность рассчитывается как сумма произведений изотонических коэффициентов на молярные концентрации всех компонентов раствора:
В данном растворе присутствуют сильные электролиты (NаCl, NaHCO3, MgCl2 и др.), слабые электролиты (аскорбиновая кислота) и неэлектролиты (глюкоза). Так как концентрации сильных электролитов в растворе малы, то величину Диссоциацией таких слабых электролитов как HCO3- и НРО42- можно пренебречь ввиду малых величин констант диссоциации (5,0×10-11 и 3,5×10-13, соответственно). Так как при рН = 7,4 концентрации ионов H+ и OH-» 10-7 моль/л, то ими также можно пренебречь. Степень диссоциации аскорбиновой кислоты найдем по формуле закона Оствальда:
Решая квадратное уравнение:
получим: a» 0,3,
Таким образом, осмолярность раствора равна:
Вопросы для самоконтроля 1. Какие свойства растворов называются коллигативными? Приведите примеры. 2. Что такое насыщенный пар? Какие характеристики насыщен-ного пара вы знаете? 3. Как давление насыщенного пара растворителя зависит от температуры? Изобразите эту зависимость схематично. Укажите точки, соответствующие фазовым превращениям. 4. Почему давление насыщенного пара растворителя над раствором нелетучего неэлектролита ниже давления насыщенного пара над чистым растворителем? Как это выглядит на графике? 5. Сформулируйте закон Рауля. Какие следствия из него вы знаете? 6. От чего зависят значения эбулиоскопической и криоско-пической констант? Какова их размерность? В чем заключается физический смысл этих констант? 7. Что такое диффузия? Что такое осмос? В чем заключается сходство и в чем различие этих процессов? 8. Что такое осмотическое давление? Как формулируется гидро-статическая интерпретация этого термина? 9. По какой формуле вычисляется осмотическое давление? От чего зависит значение осмотического давления раствора? В каких единицах выражается осмотическое давление? 10. Что такое изотонический коэффициент? Как он рассчи-тывается? 11. Какова биологическая роль осмоса? Приведите примеры применения осмоса в повседневной жизни и в лечебных целях. 12. Какие растворы называют изотоничными? Что представляет собой физиологический раствор? 13. Какие растворы называют гипертоническими? Какие гипо-тоническими? 14. Что такое плазмолиз, лизис, гемолиз? 15. Почему для растений, хорошо переносящих холод и засуху, характерна высокая концентрация веществ в клетке? Варианты задач для самостоятельного решения Примечание. Значения криоскопических и эбуллиоскопических констант, а также температуры кипения и кристаллизации растворителей, приведены в таблице 1. Вариант №1 1. Вычислить температуру кипения и температуру кристалли-зации раствора, содержащего 1,5 г нафталина (C10H8) в 50 г бензола. 2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 7 атм, если ее поместить в раствор сахарозы с w(С12Н22О11) = 6% плотностью 1,05 г/мл при 200C. 3. Раствор, содержащий 2,22 г СаСl2 в 100 г воды, кристаллизует-ся при -0,930С. Рассчитать кажущуюся степень диссоциации СаСl2 и осмотическое давление раствора при 150C, если rр-ра» 1 г/мл. Вариант №2 1. Вычислить температуру кипения и температуру кристалли-зации 5% водного раствора NaCl, если aк = 80%. 2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 3,5 атм, если ее поместить в раствор сульфата железа (III) с w(Fe2(SO4)3) = 2% (r = 1,1 г/мл, 3. Раствор, содержащий 13 г неэлектролита в 400 г диэтилового эфира, кипит на 0,4530С выше по сравнению с чистым растворителем. Вычислить молярную массу растворенного вещества и осмотическое давление раствора при 100C, если rр-ра = 0,75 г/мл. Вариант №3 1. Рассчитать массу С12Н22О11, которую необходимо растворить в 100 мл воды, чтобы: а) понизить температуру кристаллизации раствора на 10С; б) повысить температуру кипения раствора на 0,40С. 2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 7 атм, если ее поместить в раствор хлорида калия c w(KCl) = 7,5% (r = 1,1 г/мл, 3. В 200 мл раствора содержится 2,8 г высокомолекулярного соединения. При 250С осмотическое давление этого раствора составляет 0,7 Па. Найти молярную массу полимера. Вариант №4 1. Вычислить температуру кипения и температуру кристалли-зации раствора, содержащего 12 г глюкозы (C6H12O6) в 200 мл воды. 2. Рассчитать количество растворенного вещества (неэлектро-лита) в 100 мл раствора, осмотическое давление которого при 200С составляет 245 кПа. 3. Температура кристаллизации водного раствора мочевины составляет -0,3720С. Рассчитать осмотическое давление данного раствора при 130C если rр-ра» 1 г/мл. Вариант №5 1. Раствор, содержащий 100 г ацетона и 2,3 г глицерина, кипит при 56,580С, а кристаллизуется при -95,350С. Вычислить K и E ацетона. 2. К 100 мл водного раствора мочевины с молярной концен-трацией 0,5 моль/л добавили 400 мл воды и понизили температуру от 25 до 50С. Определить, как во сколько раз изменится осмотическое давление раствора. 3. Температура кипения спиртового раствора иода, содержащего 8,8 г иода в 200 г этанола, составляет 78,60С. Установить молекуляр-ную формулу иода. Вариант №6 1. Рассчитать температуру кипения и температуру кристалли-зации водного раствора хлорида алюминия с b(AlCl3) = 0,03 моль/л, если 2. Найти массу глюкозы в 0,2 л раствора, осмотическое давление которого при 370С составляет 810 кПа. 3. Понижение температуры кристаллизации раствора, содержа-щего 0,3 г СН3СООН в 50 г воды, равна 0,1880С. Найти степень диссоциации уксусной кислоты и осмотическое давление раствора при 270C, если rр-ра» 1 г/мл. Вариант №7 1. Вычислить температуру кипения и температуру кристалли-зации 10%-го водного раствора глицерина (C3H8O3).
2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 7,6 атм, если ее поместить в раствор хлорида натрия c w(NaCl) = 0,87% (r = 1,06 г/мл, 3. Раствор, содержащий 2,1 г КОН в 250 г воды, кристаллизуется при -0,5190С. Рассчитать кажущуюся степень диссоциации КОН и осмотическое давление раствора при 00C, если rр-ра» 1 г/мл. Вариант №8 1. Рассчитать массу мочевины СО(NН2)2, которую необходимо растворить в 200 мл воды, чтобы: а) понизить температуру кристаллизации раствора на 10С; б) повысить температуру кипения раствора на 0,350С. 2. Найти, в каком объемном соотношении следует развести раствор с осмотическим давлением 2,5 МПа водой, чтобы снизить осмотическое давление раствора до 0,5 МПа. 3. Водный раствор, содержащий 15% неэлектролита, кристал-лизуется при -5,60С. Вычислить молярную массу неэлектролита и осмотическое давление раствора, если rр-ра = 1,1 г/мл. Вариант №9 1. Рассчитать температуру кипения и температуру кристаллиза-ции водного раствора хлорида магния с b(MgCl2) = 0,05 моль/л, если 2. Определить, как и во сколько раз изменится осмотическое дав-ление раствора неэлектролита, если температуру раствора повысить от 5 до 350С. 3. Определить, изотоничны ли при одинаковой температуре водные растворы иодида калия с С(КI) = 0,1 моль/л, ( Вариант №10 1. Вычислить температуру кипения и температуру кристал-лизации раствора, содержащего 2,5 г фенола (C6H5OH) в 90 г бензола. 2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 15 атм, если ее поместить в раствор хлорида кальция c w(СaCl2) = 10% (r = 1,1 г/мл, 3. Осмотическое давление раствора, содержащего 9 г маннита (неэлектролит) в 250 мл раствора, при 00С составляет 456 кПа. Рассчитать молярную массу маннита. Вариант №11 1. Рассчитать, сколько г глюкозы С6Н12О6 следует растворить в 250 мл воды, чтобы: а) понизить температуру кристаллизации раствора на 1,50С; б) повысить температуру кипения раствора на 0,250С. 2. Определить температуру, при которой должен находиться раствор, содержащий 0,35 моль неэлектролита в 1 л раствора, чтобы быть изотоничным раствору, содержащему при 200С 6,2 г этилен-гликоля в 250 мл раствора. 3. Температура кипения раствора, содержащего 13 г камфоры (неэлектролит) в 400 г диэтилового эфира, составляет 34,950С. Вычислить молярную массу камфоры и осмотическое давление раствора при 50С, если rр-ра» 1 г/мл. Вариант №12 1. Найти массу AgNO3 в 50 мл воды, если известно, что данный раствор кристаллизуется при -0,3720С, а 2. Вычислить, при какой температуре осмотическое давление раствора, содержащего 36 г глюкозы в 1 л, достигнет 520 кПа. 3. При 200С осмотическое давление раствора, содержащего 1,2 г неэлектролита в 200 мл водного раствора, составляет 243,18 кПа. Вычислить молярную массу неэлектролита, температуру кипения и температуру кристаллизации раствора, если rр-ра» 1 г/мл. Вариант №13 1. В равных объемах воды растворены одинаковые массы сахаро-зы (М = 342 г/моль) и альбумина (М = 68000 г/моль). Определить, какой из растворов кристаллизуется при более низкой температуре. 2. В равных объемах бензола растворены одинаковые массы нафталина (C10H8) и антрацена (C14H10). Определить, как и во сколько раз отличаются значения осмотического давления этих растворов. 3. Определить, изотоничны ли водные растворы хлорида кальция с C(СаСl2) = 0,1 моль/л ( Вариант №14 1. Вычислить температуру кипения и температуру кристаллиза-ции раствора, содержащего 500 г этиленгликоля (C2H6O2) в 4 л воды. 2. Определить, что произойдет с клеткой, осмотическое давление внутри которой 2,5 атм, если ее поместить в раствор карбоната натрия с w(Na2CO3) = 10% (r = 1,06 г/мл, 3. Раствор, содержащий 3,24 г серы в 40 г бензола, кипит на 0,810С выше, чем чистый растворитель. Определить молекулярную формулу серы. Вариант №15 1. Рассчитать температуру кипения и температуру кристал-лизации водного раствора сульфата меди с w(CuSO4) = 0,8%, если 2. При одной и той же температуре раствор, содержащий 3,7 г глюкозы в 0,5 л раствора, изотоничен раствору мочевины. Найти массу мочевины в 1 л раствора. 3. Раствор, содержащий 42 г неэлектролита в 420 г воды, кипит при 100,250С. Определить молярную массу растворенного вещества и осмотическое давление раствора при 350С, если rр-ра = 1,1 г/мл. Вариант №16 1. Вычислить температуру кипения и температуру кристаллиза-ции раствора, содержащего 1 г нитробензола (C6H5NO2) в 10 г бензола. 2. Определить, будут ли при одинаковой температуре изото-ничны растворы сахара (С12Н22О11) и глюкозы (С6Н12О6), с концен-трациями, равными, соответственно, 0,5 моль/л и 30 г/л. 3. Раствор, содержащий 4,11 г KNO3 в 100 мл воды, кипит при 100,3980С. Рассчитать Вариант №17 1. Вычислить температуру кипения и температуру кристаллиза-ции раствора, содержащего 15 г хлороформа (CHCl3) в 400 г диэтилового эфира. 2. Рассчитать осмотическое давление раствора пировиноградной кислоты с концентрацией 0,025 моль/л при 250С, если 3. В равных объемах воды растворены 0,5 моль СаСl2 и 0,2 моль сахара (С12Н22О11). Найти кажущуюся степень диссоциации СаСl2, если температуры кристаллизации обоих растворов одинаковы. Вариант №18 1. Раствор, содержащий 2,5 г ДМСО ((CH3)2SO) в 90 г бензола кипит при 81,010С, а кристаллизуется при 3,680С. Найти K и E бензола. 2. Вычислить массу глюкозы в 1 л раствора, если известно, что при одинаковой температуре этот раствор изотоничен формалину, содержащему 1,5 г формальдегида в 0,5 л раствора. 3. Понижение температуры кристаллизации водного раствора, содержащего 1,5 г неэлектролита в 50 мл воды, составляет 0,930С. Рассчитать молярную массу неэлектролита и осмотическое давление раствора при 220С, если rр-ра» 1 г/мл. Вариант №19 1. Рассчитать массу KOH, которую следует растворить в 350 мл воды, чтобы: а) понизить температуру кристаллизации раствора на 0,5580С; б) повысить температуру кипения раствора на 0,1560С.
2. Вычислить изотонический коэффициент для раствора электролита с молярной концентрацией 0,01 моль/л, если в 1 л этого раствора содержится 6,45×1021 частиц (молекул и ионов) растворен-ного вещества. 3. Раствор, содержащий 2 г серы в 40 г бензола кристаллизуется при 4,50С. Установить молекулярную формулу серы. Вариант №20 1. Экспериментально установлено, что водные растворы этилен-гликоля с концентрациями 52,6% и 66% кристаллизуются, соответст-венно, при температурах -400С и -650С. Рассчитать значения температур кристаллизации этих растворов при помощи следствий из закона Рауля и объяснить причину наблюдаемых различий между теоретически рассчитанными и экспериментально измеренными значениями температур кристаллизации растворов. На основании имеющихся данных сделать вывод: можно ли использовать 40% водный раствор этиленгликоля в качестве антифриза при -200С? 2. При 200С смешали два раствора неэлектролита: 1 л раствора с p = 400 кПа и 2 л раствора с p = 250 кПа. Вычислить осмотическое давление полученного раствора. 3. Раствор 2,13 г неизвестного вещества в 60 г бензоле не проводит ток и кристаллизуется при 4,250С. Установить формулу вещества, если массовые доли элементов составляют: 50,69% углерода, 4,23% водорода и 45,08% кислорода. БЛОК ИНФОРМАЦИИ Буферные системы Функциональное состояние живых организмов неразрывно связа-но с постоянством активной реакции среды тканей, органов и ряда биологических жидкостей (крови, слюны, желудочного сока и др.), определяемой водородным показателем (рН). Состояние кислотно-основного равновесия, соответствующее норме, называется протоли-тический гомеостаз. Смещение протолитического равновесия в кис-лую область (снижение рН) вызывает ацидоз, в щелочную (повыше-ние рН) - алкалоз. Возникновение этих отклонений может быть выз-вано разными причинами. Например, в процессе метаболических превращений в клетках организма образуются кислоты (угольная, серная, фосфорная, молочная и др.) и основания (аммиак, азотистые основания). Выделе-ние этих веществ в количествах, превышающих допустимую норму, может привести к ацидозу или алкалозу. В процессе тканевого дыхания в организме высвобождается большое количество углекислого газа. Транспорт СО2 осуществля-ется кровью, которая представляет собой одну из важнейших внут-ренних сред организма и характеризуется определенным диапазоном колебаний рН – от 7,37 до 7,45 со средней величиной 7,38-7,40. Даже небольшие отклонения рН крови от нормы свидетельствуют о патологических нарушениях метаболизма. Величины рН крови ниже 6,8 и выше 7,8 несовместимы с жизнью. Присутствие кислотных оксидов (таких как СО2) может вызвать сдвиг значений рН раствора в область более низких значений, что в данном случае может привести к серьезным физиологическим нару-шениям. Действительно, вопреки распространенному мнению, дли-тельное пребывание человека в замкнутом пространстве приводит к удушью и гибели не из-за недостатка кислорода, а из-за избытка СО2. Однако, присутствие в крови допустимых концентраций кислот, оснований или углекислого газа не вызывает нарушений кислотно-основного гомеостаза. Это означает, что в организме присутствуют системы, способные поддерживать концентрацию ионов водорода на заданном уровне. Таких систем в организме человека три: дыхатель-ная система (легкие), выделительная система (почки) и комплекс буферных систем. Действительно, от кислотных оксидов (CO2) организм освобож-дается благодаря процессу дыхания, а нелетучие кислоты и основа-ния выводятся через почки с мочевыведением. Однако эти физиоло-гические процессы протекают медленно, быстрая же нейтрализация этих веществ и поддержание постоянства pH в норме осуществляется за счет физико-химических процессов, среди которых главная роль принадлежит протолитическим равновесиям в буферных системах биологических сред организма. Типы буферных систем Буферные системы (буферы) – это равновесные системы, способные поддерживать постоянство рН при разбавлении раствора или при добавлении к нему некоторого количества сильной кислоты или щелочи. Эта способн
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 2557; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.56.251 (0.012 с.) |

 = 1.
= 1. ,
,





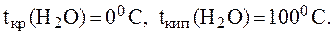



 *
*




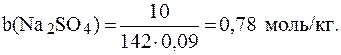



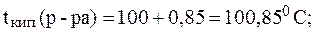





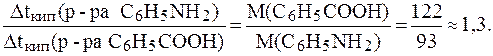
 , следовательно, раствор анилина кипит при более высокой темпе-ратуре.
, следовательно, раствор анилина кипит при более высокой темпе-ратуре.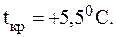

 .
.



 ;
;

 .
. ,
,



 ;
;


 .
.

 раствора:
раствора:



 (CH3CH(OH)COOH) = 4.
(CH3CH(OH)COOH) = 4. .
.
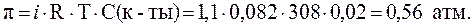




 , 0,28 ммоль Nа2НРО4, и имеет рН = 7,4. Рассчитать осмолярность данного раствора.
, 0,28 ммоль Nа2НРО4, и имеет рН = 7,4. Рассчитать осмолярность данного раствора.
 можно принять равной 1 и считать, что i = n. Таким образом, для бинарных сильных электролитов (NаCl, NaHCO3, KHCO3) i = 2, для всех остальных (MgCl2, K2SO4, Nа2НРО4 и глюко-ната кальция) i = 3.
можно принять равной 1 и считать, что i = n. Таким образом, для бинарных сильных электролитов (NаCl, NaHCO3, KHCO3) i = 2, для всех остальных (MgCl2, K2SO4, Nа2НРО4 и глюко-ната кальция) i = 3.






