
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Смещение гетерогенного равновесияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте 1. Влияние одноименного иона. Из постоянства величины ПР не следует постоянство концен-траций отдельных ионов и концентрацию каждого из них можно варьировать в определенных пределах. Так, можно увеличить концен-трацию иона Аnn-(или Ktm+), добавив, например, вещество с одно-именным ионом – это немедленно отразится на состоянии равно-весия: оно сдвинется в направлении образования осадка, т. к. избы-точное, по сравнению с равновесным количеством, содержание ионов Аnn- (или Ktm+) приведет к увеличению скорости реакции осаждения (nKtm+ + mАnn- При добавлении одноименного иона, например Аnn-, в системе установится равновесие, которое будет по-прежнему описываться уравнением (1) и количественно характеризоваться той же величиной Пример 4. Сравнить растворимостьсульфата бария в воде и в растворе хлорида бария с С(BaCl2) = 0,01 моль/л. Решение. Растворимость сульфата бария (ПР = 1,1∙10-10) в воде составляет:
Очевидно, что в насыщенном растворе BaSO4: P(BaSO4) = C(Ba2+) = C(SO42-). Добавление в раствор растворимой соли бария приводит к повы-шению концентрации ионов Ba2+. Согласно принципу Ле Шателье, равновесие: BaSO4 ⇄ Ba2+ + SO42-
смещается в сторону образования осадка и растворимость сульфата бария снижается. В данном случае концентрация катионов бария складывается из концентрации ионов Ba2+ в насыщенном растворе BaSO4 (10-5 моль/л) и концентрации катионов, образовавшихся при диссоциации BaCl2 (0,01 моль/л). Ввиду того, что концентрация ионов Ba2+ в насыщенном растворе BaSO4 на три порядка меньше, чем в растворе BaCl2, то ей можно пренебречь, считая, что С(Ва2+) = 0,01 моль/л. Поэтому:
Отсюда:
Таким образом, при осаждении сульфатов в виде BaSO4 добав-ление BaCl2 понижает растворимость сульфата бария и способствует более полному выведению сульфатов из раствора. 2. Влияние посторонних ионов. Введение в насыщенный раствор вещества-электролита, не содержащего одноименных ионов с осадком, напротив, повышает растворимость соединения (солевой эффект). Причиной солевого эффекта является усиление межионных взаимодействий, способст-вующих переходу ионов вещества из кристаллической решетки (твердой фазы) в раствор. Так, растворимость сульфата бария в растворе хлорида натрия - сильного электролита, не образующего одноименных ионов с осадком - выше, чем в чистой воде. 3. Влияние кислотности среды. В некоторых случаях малорастворимые соли слабых кислот растворяются в более сильных кислотах. Добавление сильной кислоты повышает концентрацию ионов H+, которые с анионами соли образуют малодиссоциированную слабую кислоту. При этом концен-трация аниона понижается, и гетерогенное равновесие смещается в сторону растворения осадка. Так, малорастворимый в воде карбонат бария легко растворяется при добавлении соляной кислоты, поскольку из-за протекания реакции: 2H+ + CO32- ⇄ H2CO3 ⇄ СО2 + H2O в растворе снижается концентрация ионов СО32- и равновесие: BaCO3 ⇄ Ba2+ + CO32-
смещается в сторону растворения осадка. Рассмотрим процесс растворения малорастворимого сильного электролита, состоящего из однозарядного катиона и однозарядного аниона слабой кислоты KtAn при добавлении кислоты. Подкисление раствора приводит к частичному связыванию аниона в малодиссоци-ированное соединение: H+ + Аn- поэтому в растворе наряду с ионами Аn- появляются молекулы HАn. Таким образом, общая концентрация свободных и связанных анионов составит: С(An-) = [An-] + [HAn]. Поскольку
то:
Отсюда:
Выражение для ПР будет иметь вид:
следовательно:
Для малорастворимых солей, образованных слабыми двух-основными кислотами, справедливо уравнение:
Из уравнений (4) и (5) можно сделать следующие выводы: Чем больше произведение растворимости соли и чем меньше константа диссоциации образующейся слабой кислоты, тем больше растворяющее действие прибавляемой кислоты на осадок. Чем слабее кислота, соответствующая аниону соли (т.е. чем меньше Пример 5. Сравнить растворимость нитрита серебра при pH = 7 и pH = 3, если Решение. Так как в состав данной соли входит анион слабой одноосновной кислоты, то согласно формуле (4) при pH = 7:
Поскольку величина 2,5×10-4 << 1, то:
При pH = 3:
Таким образом, при снижении pH от 7 до 3 растворимость нитрита серебра увеличивается почти в 2 раза. Пример 6. Сравнить растворимость оксалата и тартрата кальция в кислой среде при одинаковом pH, если Решение. Оксалат кальция (СаС2О4) и тартрат кальция (
Согласно формуле (5), осадок тартрата кальция растворится при более низкой концентрации ионов Н+ (более высоком значении рН), чем осадок оксалата кальция. Это означает, что при одинаковом pH растворимость тартрата кальция выше, чем оксалата кальция. Можно привести и другие примеры, подтверждающие справед-ливость уравнений (4) и (5). Действительно, все карбонаты раство-римы даже в слабых кислотах, тогда как большинство фосфатов - только в сильных. Соли, имеющие низкие значения ПР (например, сульфиды), не растворимы даже в сильных кислотах. Не растворимы в сильных кислотах и соли, образованные анионами сильных кислот (например, AgCl), так как при этом не образуются малодиссоцииро-ванные соединения. Большинство веществ, представляющих твердую фазу в биосис-темах в норме и при патологии, являются кальциевыми солями слабых кислот и их растворимость будет увеличиваться с повы-шением кислотности среды. При этом легче будут растворяться соли, образованные более слабыми кислотами. 3. Влияние процесса образования комплексного соединения. Присутствие веществ, способных образовывать с ионами, входя-щими в состав осадка, прочные комплексные соединения, также спо-собствует растворению осадка. При этом в реакцию комплексооб-разования вступают ионы, входящие в состав осадка, и понижение их концентрации смещает гетерогенное равновесие в сторону раство-рения осадка. Так, малорастворимый в воде и сильных кислотах хлорид серебра AgCl легко растворяется в водном растворе аммиака за счет образо-вания малодиссоциированного комплексного катиона [Ag(NH3)2]+: Ag+ + 2(NH3×H2O) Понижение концентрации катионов Ag+ смещает равновесие AgCl ⇄ Ag+ + Cl- вправо, т.е. в сторону растворения осадка. Оба процесса (осаждения и комплексоообразования) характери-зуются величинами DG0. Так, для процесса осаждения, который протекает по уравнению:
 KtnAnm(тв.) KtnAnm(тв.)
величину DG0 можно рассчитать по уравнению:
Так как [KtnAnm(тв.)] = 1, а [Ktm+]∙[Ann-] = ПР, то можно записать:
Для процесса комплексообразования:
где Из уравнений (6) и (7) видно, что чем меньше величина ПР или Если выполняется соотношение:
то вследствие выигрыша энергии произойдет растворение осадка. Таким образом: Чем прочнее образующееся комплексное соединение (чем больше Пример 7. Объяснить эффект просветления раствора, содержа-щего взвесь Zn(OH)2 в воде, при добавлении избытка щелочи. Решение. Просветление раствора происходит за счет протекания реакции: Zn(OH)2 + 2OH- которая сопровождается образованием хорошо растворимого комп-лексного соединения. 4. Влияние окислительно-восстановительных процессов. Если в состав малорастворимого электролита входит ион, способ-ный проявлять окислительные (восстановительные) свойства, то добавление соответствующего восстановителя (окислителя) к насы-щенному раствору этого вещества может способствовать увеличению его растворимости. Так, практически не растворимый в воде и в сильных кислотах осадок CuS растворяется в азотной кислоте HNO3 за счет окисления ионов S2-: NO3- + 4H+ + 3ē S2- + 4H2O - 8ē В результате ионов S2- становится меньше, и гетерогенное рав-новесие CuS ⇄ Cu2+ + S2- смещается в сторону растворения осадка. Изменение энергии Гиббса DG0 при протекании окислительно-восстановительного процесса определяется разностью стандартных потенциалов окислителя и восстановителя (подробнее см. ч. IV, глава «Электродные потенциалы на границе раздела фаз»):
Если DG0 окислительно-восстановительной реакции превышает DG0 процесса осаждения, то происходит растворение осадка. Процесс растворения осадка тем более вероятен, чем больше разность стандартных потенциалов окислителя и восстановителя (ЭДС), т. е. чем более сильный окислитель применен для растворения осадка со свойствами восстановителя или чем более сильный восстановитель использован для растворения осадка со свойствами окислителя. Пример 8. Определить, какой из имеющихся окислителей, КМnО4 или I2, более эффективен при растворении осадка СаС2О4. Решение. Для растворения СаС2О4, содержащего анион С2О42-, который проявляет свойства восстановителя, следует взять КМnО4, а не I2, так как первый является более сильным окислителем. Действительно:
следовательно, в первом случае: ЭДС1 = 1,51 - (-0,50) = 2 В, а во втором: ЭДС2 = 0,5 - (-0,5) = 1 В, т. е. в два раза меньше. 5. Влияние конкурирующих гетерогенных равновесий. Присутствие в биожидкостях большого числа ионов приводит к тому, что одновременно могут образовываться несколько малораст-воримых электролитов. Последовательность выпадения осадков, в большинстве случаев, определяется уравнением (6) и для однотипных электролитов справедливо правило: Чем меньше ПР осадка, тем раньше или при меньшей концен-трации ионов Ktm+ или Аnn-, начнет выпадать осадок. Пример 9. Определить минимальные концентрации ионов Ca2+ и Sr2+, при которых в растворе серной кислоты с С(H2SO4) = 0,01 моль/л образуются осадки, если Произойдет ли образование осадка, если концентрации катионов одинаковы и составляют С(Ca2+) = С(Sr2+) = 10-4 моль/л? Решение. Концентрации ионов кальция и стронция, при которых из раст-вора с С(SO42-) = 0,01 моль/л начнется выпадение осадка, равны:
Следовательно, осадок SrSO4 выпадет при меньшей концент-рации катионов, чем осадок CaSO4. Если концентрации катионов одинаковы и равны 10-4 моль/л, то при концентрации С(SO42-) = 0,01 моль/л будет образовываться осадок SrSO4, а не CaSO4, так как соотношение между
В случае конкурирующих гетерогенных равновесий разнотипных электролитов для установления последовательности выпадения осадков следует сравнивать не значения ПР, а величины раство-римостей, расчет которых проводится по формуле (2). Очевидно, что в первую очередь будет выпадать осадок, который имеет наимень-шую растворимость. Зная величины ПР, можно выделять из смеси ка-тионов или анионов отдельный компонент в виде осадка. Такой под-ход лежит в основе фракционного разделения катионов или анионов. Пример 10. Определить, какой из имеющихся реактивов: йодид натрия NaI, карбонат натрия Na2CO3 или сульфид натрия Na2S может быть использован для отделения магния от свинца в растворе, содержащем одинаковые концентрации (по 0,001 моль/л) нитратов магния и свинца. Решение. В водном растворе ион Рb2+ образует с ионом I- малорастворимый осадок РbI2 ( Взаимодействуя с ионом CO32-, ионы Рb2+ и Mg2+ в обоих случаях образуют малорастворимые соединения РbCO3 и MgCO3. Концентрация карбонат-ионов, необходимая для выпадения осад-ков, составляет: в случае MgСО3: в случае PbСО3: Если добавлять карбонат натрия к раствору в таких количествах, чтобы концентрация СО32- не превышала 0,02 моль/л, то можно оса-дить свинец в виде PbCO3, а магний останется в растворе. С ионом S2- оба катиона (Mg2+ и Pb2+) образуют малораство-римые соединения MgS ( Образование осадка начнется при концентрации сульфид ионов: в случае MgS: в случае PbS: Из приведенного расчета видно, что концентрация сульфид-ионов очень мала, поэтому поддерживать ее величину на уровне, достаточном для выпадения осадка одного из компонентов, практи-чески невозможно. Таким образом, использовать Na2S для отделения Рb2+ от Mg2+ нецелесообразно.
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1546; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 KtnAnm).
KtnAnm). , но другими равновесными концентрациями ионов Ktm+ и Аnn-. Концентрация ионов Ktm+ во вновь установившемся равновесии уменьшится по сравнению с предыдущим равновесным состоянием (до добавления избыточного количества иона Аnn-) за счет того, что часть ионов Ktm+ вступит в реакцию осаждения с избыточным количеством ионов Аnn-. Концентрация ионов Аnn-, наоборот, будет больше, чем в предыдущем равновесии.
, но другими равновесными концентрациями ионов Ktm+ и Аnn-. Концентрация ионов Ktm+ во вновь установившемся равновесии уменьшится по сравнению с предыдущим равновесным состоянием (до добавления избыточного количества иона Аnn-) за счет того, что часть ионов Ktm+ вступит в реакцию осаждения с избыточным количеством ионов Аnn-. Концентрация ионов Аnn-, наоборот, будет больше, чем в предыдущем равновесии. .
. .
.
 ,
, .
. .
. ,
,

 ), тем меньшее подкисление раствора требуется для увеличения растворимости соли.
), тем меньшее подкисление раствора требуется для увеличения растворимости соли.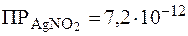 ,
, 
 .
. .
.
 ,
,  ,
,  ,
, 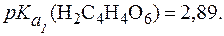
 ) имеют сопоставимые значения ПР, но при этом:
) имеют сопоставимые значения ПР, но при этом: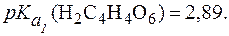


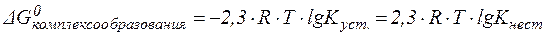 ,
,
 и
и  - константы равновесия процессов комплексо-образования и диссоциации комплекса, соответственно (подробнее см. главу «Комплексные соединения»).
- константы равновесия процессов комплексо-образования и диссоциации комплекса, соответственно (подробнее см. главу «Комплексные соединения»). ,
,
 ), тем больше смещено равновесие в сторону образования комплекса, т. е. растворения осадка.
), тем больше смещено равновесие в сторону образования комплекса, т. е. растворения осадка. .
.
 ;
;  ;
;  ,
, ,
,  .
. ;
; .
. и ПР осадков различное:
и ПР осадков различное: ;
; .
.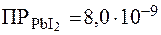 ), тогда как MgI2 хорошо растворим. Поэтому соль NaI может быть использована для отделения Рb2+ от Mg2+ путем перевода свинца в осадок.
), тогда как MgI2 хорошо растворим. Поэтому соль NaI может быть использована для отделения Рb2+ от Mg2+ путем перевода свинца в осадок. ;
;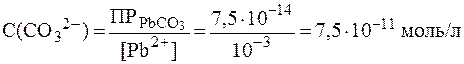 .
. ) и PbS (
) и PbS ( ).
). ;
; .
.


