
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Биологическая роль гетерогенных равновесийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Рассмотренная теория гетерогенного равновесия и факторы, влияющие на него, позволяют медикам со знанием дела использовать препараты, применяемые для коррекции гетерогенных равновесий в организме. Важную роль в организме играют гетерогенные равновесия между ионами Са2+, РО43-, ОН- и костной тканью, основу которой составляет гидроксиапатит Са10(РО4)6(ОН)2. Для нормального функционирования организма вреден как недостаток кальция, так и его избыток. В первом случае для смещения гетерогенного равновесия в сторону образования гидроксиапатита внутрь прини-мают растворимые соли кальция. При избытке ионов Са2+ в организме самопроизвольно происходит смещение гетерогенного равновесия в сторону образования осадка, что может сопровождаться окостенением скелета, артритом и другими физиологическими отклонениями. В этом случае применяют динатриевую соль этилендиаминтетрауксус-ной кислоты (ЭДТА), которую также называют трилон Б (Na2H2Tr). При этом ионы Са2+ сыворотки крови связываются в прочный комплекс: Са2+ + H2Tr2- и выводятся из организма. Потеря ионов Са2+ возмещается за счет мобилизации кальция из костной ткани и избыточных отложений солей кальция в организме. Распространенным заболеванием является кариес зубов. Эта патология также связана со смещением гетерогенного равновесия. Кариес зубов начинается с образования на поверхности зуба повреж-денного участка эмали. Под действием кислот, вырабатываемых бактериями, происходит частичное растворение гидроксиапатита, который входит в состав зубной эмали: Са10(РО4)6(ОН)2 + 14Н+ В качестве средства, корректирующего нарушение гетерогенного равновесия и повышающего сопротивляемость зубов к кариесу, используют фторид натрия NaF. Применение NaF способствует осаж-дению фторапатита, тем самым ускоряя процесс реминерализации (образование кристаллов): 10Ca2+ + 6PO43-+ 2F- Кроме того, фторид-ионы легко замещают гидроксид-ионы в гидроксиапатите, образуя менее растворимый (и более твердый) защитный слой фторапатита: Са10(РО4)6(ОН)2 + F- Следует отметить, что предельно допустимой концентрацией фторид-ионов в питьевой воде является 1 мг/л. Превышение этой концентрации может привести к другому заболеванию - фторозу. Эталоны решения задач 1. При 250С в 1 л раствора содержится 0,0044 г SrCO3. Найти произведение растворимости SrCO3. Решение. Из уравнения реакции растворения соли в воде:
видно, что 1 моль растворенного SrCO3 при диссоциации образует 1 моль ионов Sr2+ и 1 моль ионов СО32-. Количество SrCO3, растворяющееся в 1 л при 250С, найдем по формуле (3):
2. В насыщенном растворе Ag2CrO4 концентрация CrO42- равна 10-4 моль/л. Найти Решение. Диссоциация Ag2CrO4 в растворе происходит по уравнению: Ag2CrO4 Из стехиометрического соотношения между ионами следует, что в насыщенном растворе [Ag+] = 2×[СrО42-] = 2×10-4 моль/л. Запишем математическое выражение для
3. Решение. Запишем уравнение динамического равновесия между осадком CaSO4 и его насыщенным: раствором:
Растворимость сульфата кальция в насыщенном растворе связана с величиной ПР:
Растворимость соли в г/л найдем по формуле (3):
4. Найти концентрации ионов Ca2+ и OH- в насыщенном растворе Ca(OH)2. Решение. Запишем уравнение гетерогенного равновесия:
Так как для Ca(OH)2
Таким образом: [Са2+] = P = 1,1×10-2 моль/л; [OH-] = 2×P = 2,2×10-2 моль/л. 5. Найти минимальный объем воды, необходимый для раство-рения 1 г сульфата свинца. Решение. По таблице 1 находим, что
Так как P(PbSO4) = C(PbSO4), то из формулы для расчета моляр-ной концентрации получим:
Поскольку раствор разбавленный, то можно считать 6. Определить, выпадет ли осадок при сливании 40 мл раствора нитрата серебра с С(AgNO3) = 0,001 моль/л и 10 мл раствора карбоната калия c С(K2CO3) = 0,002 моль/л. Решение. Осадок карбоната серебра, полученный по обменной реакции, выпадет при условии, что произведение концентраций ионов Концентрации ионов в исходных растворах составляют: С0(Ag+) = C0(AgNO3) = 0,001 моль/л; С0(CO32-) = C0(K2CO3) = 0,002 моль/л. При смешивании растворов суммарный объем раствора увели-чится, поэтому концентрации ионов в полученном растворе снизятся. Но при этом количества растворенных веществ не изменяются и выполняется соотношение:
Отсюда:
Произведение концентраций ионов равно:
Осадок карбоната серебра выпадет, поскольку 7. Найти минимальную концентрацию раствора карбоната натрия, чтобы добавление его к равному объему раствора нитрата серебра с С(AgNO3) = 0,001 моль/л вызвало выпадение осадка. Решение. Осадок карбоната серебра, полученный по обменной реакции, выпадет при условии, что Концентрация ионов Ag+ в исходном растворе составляет 0,001 моль/л. После смешивания с равным объемом раствора Na2CO3 концентрация ионов Ag+ уменьшится вдвое и составит 0,0005 моль/л. Если принять исходную концентрацию ионов СО32- за х моль/л, то после смешивания равных объемов растворов она также умень-шится вдвое и составит 0,5 х моль/л. Тогда произведение концентраций ионов
Минимальная концентрация Na2СО3, необходимая для достиже-ния ПР равна:
8. Определить растворимость карбоната кальция в воде, в раст-воре хлорида кальция с С(CaCl2) = 0,01 моль/л и в растворе с рН = 5, если для угольной кислоты: Решение. Растворимость карбоната кальция в воде с учетом
В растворе хлорида кальция С(Са2+) = 0,01 моль/л, поскольку диссоциацией растворенной части карбоната кальция можно пренеб-речь. Поэтому растворимость равна:
При рН = 5 (т.е. [H+] = 10-5 моль/л) растворимость карбоната кальция составит:
9. Определить, как и во сколько раз изменится растворимость CaF2, если к 1 л насыщенного раствора раствора добавить 0,21 г NaF. Решение. Растворимость CaF2 в воде Р1 можно рассчитать по величине ПР, которая для фторида кальция составляет 4∙10-11:
Концентрация фторида натрия в полученном растворе равна:
Концентрации ионов в полученном растворе c учетом добавки NaF равны: [Ca2+] = Р2; [F-] = 2∙Р2 + 5∙10-3. Концентрация фторид-ионов в насыщенном растворе CaF2 намного меньше, чем их добавленная концентрация, а в полученном растворе она станет еще меньше, поэтому ей можно пренебречь и считать, что [F-] = 5∙10-3 моль/л. Подставляя эти значения в выражение для ПР(СаF2), получаем:
Отсюда:
Таким образом, растворимость фторида кальция уменьшится в:
10. Найти рН раствора, при котором растворимость цианида серебра в 100 раз превысит растворимость соли в воде, если Решение. Растворимость цианида серебра в насыщенном растворе с учетом
Если растворимость возрастет в 100 раз, то она составит:
Поскольку цианид серебра - соль, образованная слабой кислотой, то ее растворимость зависит от концентрации ионов водорода в растворе:
Из этого выражения находим, что:
Подставляя значения
Таким образом, необходимый рН раствора составляет:
11. Определить минимальное значение рН, соответствующее началу выпадения осадка Mg(OH)2 из раствора хлорида магния с С(MgCl2) = 0,01 моль/л при добавлении щелочи. Решение. Согласно таблице 1,
Концентрация катионов Mg2+ в растворе хлорида магния равна 0,01 моль/л, следовательно:
Таким образом:
Соответственно,
Вопросы для самоконтроля 1. Какая система называется гомогенной? Приведите примеры. 2. Какая система называется гетерогенной? Приведите примеры. 3. В чем заключается различие между фазой и компонентом системы? Ответ подтвердите примерами. 4. Какие равновесия называют гетерогенными? Приведите при-меры. 5. Какой раствор называют насыщенным? 6. Что понимают под термином растворимость? Что такое коэффициент растворимости? В каких единицах выражают раствори-мость и коэффициент растворимости? 7. От каких факторов зависит растворимость твердых веществ? От чего зависит растворимость газов? 8. Как изменяется растворимость твердых веществ с ростом температуры и давления? 9. Как изменяется растворимость газов с ростом температуры и давления? 10. Каким правилом выражается влияние природы компонентов на их взаимную растворимость? 11. В каких растворителях лучше растворяются соли, кислоты и основания неорганической природы? 12. Какой растворитель вы выберите для растворения нафталина (C8H10)? 13. Приведите примеры малорастворимых сильных электролитов. 14. Что называется произведением растворимости малораство-римого сильного электролита? Запишите выражения произведения растворимости следующих малорастворимых электролитов: MnS, СаНРО4, MgC2O4, СаF2, Ag2SO4, Mg(OH)2, Ba3(PO4)2, As2S3, Ag3AsO3, Bi(OH)3. 15. От чего зависит величина произведения растворимости? 16. В каких случаях правило произведения растворимости неприменимо? 17. Как связаны между собой растворимость и произведение растворимости? Запишите выражения, связывающие раствори-мость (моль/л) и произведение растворимости для следующих малорастворимых электролитов: HgS, Са(Н2РО4)2, BaC2O4, PbI2, Ag2Cr2O7, Zn(OH)2, Mg3(PO4)2, As2S3, Ag3PO4, Cr(OH)3. 18. Во всех ли случаях для сопоставления растворимостей веществ можно сравнивать величины их ПР? 19. Как формулируется правило, определяющее условия выпадения или растворения осадка? 20. Всегда ли менее растворимый осадок выпадает раньше более растворимого? 21. Достаточно ли для растворения осадка уменьшить концентра-цию одного из составляющих его ионов? 22. Какие факторы могут повлиять на смещение гетерогенного равновесия? 23. В каких случаях на гетерогенное равновесие оказывает влияние активная реакция среды? Приведите примеры. 24. Все ли осадки растворимы в сильных кислотах? 25. В каких случаях возможно растворение осадка за счет комп-лексообразования? Приведите примеры. 26. В каких случаях возможно растворение осадка за счет протекания окислительно-восстановительных процессов? Приведите примеры. 27. Как изменится растворимость фосфата кальция при добавлении к раствору фосфата калия? 28. Как изменится растворимость хлорида серебра при добавле-нии к раствору сульфата меди? 29. Какова биологическая роль гетерогенных равновесий? Приведите примеры. 30. Какие профилактические меры используют для предотвращения образования камней в почках? 31. Чем обусловлен кариес зубов? 32. Какие профилактические меры используются для предотвра-щения кариеса? 33. Какова максимально допустимая концентрация фторид-ионов в питьевой воде? Варианты задач для самостоятельного решения Примечание. Значения констант произведения растворимости малораст-воримых электролитов приведены в таблице 1. Вариант №1 1. Концентрация ионов Cl- в насыщенном растворе PbCl2 состав-ляет 3,4×10-2 моль/л. Вычислить 2. Рассчитать концентрацию Ag2Cr2O7 в насыщенном растворе в моль/л и в г/л. 3. Определить, выпадет ли осадок при сливании равных объемов растворов хлорида бария с С(ВаС12) = 0,0001 моль/л и серной кислоты с С(H2SO4) = 0,00005 моль/л. 4. Найти значение рН раствора, при котором растворимость нитрита серебра увеличится вдвое, если Вариант №2 1. Концентрация ионов стронция в насыщенном растворе SrCO3 равна 9,2×10-4 г/л. Вычислить 2. Рассчитать концентрации ионов в насыщенном растворе Ag3PO4 в моль/л и в г/л. 3. Определить, выпадет ли осадок при сливании равных объемов растворов нитрата серебра с С(AgNO3) = 0,02 моль/л и сульфата натрия с С(Na2SO4) = 0,05 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Mn(OH)2 из раствора сульфата марганца с С(MnSO4) = 0,01 моль/л при добавлении щелочи. Вариант №3 1. Концентрация ионов бария в насыщенном растворе Ba3(PO4)2 составляет 2,7×10-8 моль/л. Вычислить 2. Рассчитать концентрации ионов в насыщенном растворе SrCrO4 в моль/л и в г/л. 3. Найти минимальную концентрацию раствора хромата калия, чтобы при добавлении 10 мл его к 40 мл раствора хлорида бария с С(BaCl2) = 0,0001 моль/л выпал осадок. 4. Определить, во сколько раз изменится растворимость хромата серебра, если к 1 л его насыщенного раствора добавить 1,7 г AgNO3. Вариант №4 1. При 250С концентрация катионов кальция в насыщенном растворе сульфата кальция составляет 200 мг/л. Вычислить 2. Рассчитать массу ионов Ag+ в 5 л насыщенного раствора хлорида серебра. 3. Определить, выпадет ли осадок, если к 20 мл раствора нитрата свинца с С(Pb(NO3)2) = 0,2 моль/л добавить 30 мл раствора хлорида натрия с С(NaCl) = 0,01 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Cu(OH)2 из раствора сульфата меди с С(CuSO4) = 0,001 моль/л при добавлении щелочи. Вариант №5 1. Концентрация фосфат-ионов в насыщенном растворе Sr3(PO4)2 равна 5×10-7 моль/л. Вычислить 2. Найти молярные концентрации ионов в насыщенном растворе фосфата бария. 3. Определить, выпадет ли осадок при сливании 30 мл раствора нитрата свинца c С(Pb(NO3)2) = 0,01 моль/л и 20 мл раствора иодида калия с C(KI) = 0,005 моль/л. 4. Сравнить растворимость оксалата кальция в воде, в растворе хлорида кальция c С(CaCl2) = 0,01 моль/л и в воде, подкисленной до рН = 4,5. Для щавелевой кислоты: Вариант №6 1. Растворимость Ag2Cr2O7 равна 4∙10-3 моль/л. Найти 2. Рассчитать массу ионов Ca2+ в 10 л насыщенного раствора сульфата кальция. 3. Определить, выпадет ли осадок, при сливании равных объемов растворов нитрата серебра с С(AgNO3) = 0,0003 моль/л и карбоната калия с С(K2CO3) = 0,0005 моль/л. 4. Определить растворимость сульфита меди в воде, в растворе сульфата меди c С(CuSO4) = 0,01 моль/л и в воде, подкисленной до рН = 5. Для сернистой кислоты:
Вариант №7 1. Концентрация катионов магния в насыщенном растворе фосфата магния составляет 3,0∙10-5 моль/л. Найти 2. Рассчитать концентрацию фторида бария в насыщенном растворе в моль/л и в г/л. 3. Определить, выпадет ли осадок, если к 25 мл раствора хлорида кальция С(CaCl2) = 0,01 моль/л добавить 75 мл раствора фторида натрия c С(NaF) = 0,005 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Cd(OH)2 из раствора сульфата кадмия с С(CdSO4) = 0,05 моль/л при добавлении щелочи. Вариант №8 1. Концентрация ионов свинца в насыщенном растворе PbI2 равна 1,3×10-3 моль/л. Вычислить 2. Определить, как и во сколько раз отличаются значения раство-римостей фосфата и иодида серебра. 3. Найти минимальную концентрацию раствора нитрата свинца, чтобы при добавлении 10 мл его к 90 мл раствора карбоната натрия c C(Na2CO3) = 0,0001 моль/л выпал осадок. 4. Определить, как и во сколько раз изменится растворимость цианата серебра AgOCN при подкислении раствора до рН = 3, если Вариант №9 1. В 5 л насыщенного раствора AlPO4 содержится 1,02×10-7 г катионов алюминия. Вычислить 2. Вычислить концентрацию ионов Ag+ в насыщенном растворе карбоната серебра в моль/л и в г/л. 3. Определить, выпадет ли осадок при сливании равных объемов растворов фосфата калия с С(K3РО4) = 0,0001 моль/л и нитрата серебра с С(AgNO3) = 0,00012 моль/л. 4. Рассчитать рН насыщенного раствора гидроксида бария.
Вариант №10 1. Концентрация ионов F- в насыщенном растворе CaF2 равна 4×10-4 моль/л. Вычислить 2. Рассчитать концентрацию сульфид-ионов в насыщенном растворе сульфида железа (II) в моль/л и в г/л. 3. Определить, выпадет ли осадок, если смешать 15 мл раствора нитрата свинца с С(Pb(NO3)2) = 0,01 моль/л и 25 мл раствора бромида натрия с С(NaBr) = 0,02 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Pb(OH)2 из раствора ацетата свинца с С(Pb(CH3COO)2) = 0,01 моль/л при добавлении щелочи. Вариант №11 1. В 500 мл насыщенного раствора AgI находится в растворенном виде 5,65×10-9 г катионов серебра. Вычислить 2. Рассчитать концентрацию сульфат-ионов в насыщенном растворе сульфата серебра в моль/л и в г/л. 3. Определить, выпадет ли осадок при сливании равных объемов растворов нитрата магния с С(Mg(NO3)2) = 0,0004 моль/л и фосфата натрия с С(Na3PO4) = 0,00002 моль/л. 4. Определить растворимость сульфида свинца в воде, в растворе нитрата свинца c С(Pb(NO3)2) = 0,001 моль/л и в воде, подкисленной до рН = 5,5. Для сероводородной кислоты: Вариант №12 1. Концентрация ионов Pb2+ в насыщенном растворе PbF2 равна 2×10-3 моль/л. Вычислить 2. Рассчитать концентрацию ионов Ag+ в насыщенном растворе сульфида серебра в моль/л и в г/л. 3. Определить, выпадет ли осадок при добавлении 30 мл раствора нитрата кальция С(Ca(NO3)2) = 0,002 моль/л к 20 мл раствора фторида натрия c С(NaF) = 0,005 моль/л. 4. Определить, как и во сколько раз отличается растворимость карбоната серебра в воде и в растворе нитрата серебра c С(AgNO3) = 0,01 моль/л.
Вариант №13 1. Концентрация ионов Ba2+ в насыщенном растворе BaCrO4 равна 1,7 мг/л. Вычислить 2. Рассчитать концентрацию ионов Sr2+ в насыщенном растворе фосфата стронция в моль/л и в г/л. 3. Найти минимальную концентрацию раствора серной кислоты, чтобы при добавлении 10 мл его к 90 мл 0,0002 моль/л раствора хлорида бария выпал осадок. 4. К 200 мл насыщенного раствора фосфата магния добавили 190 мг хлорида магния. Определить, как и во сколько раз изменится растворимость фосфата магния. Вариант №14 1. Масса ионов Cu2+ в 2 л насыщенного раствора CuS составляет 3,14×10-16 г. Вычислить 2. Рассчитать концентрацию иодида свинца в насыщенном растворе в моль/л и в г/л. 3. Определить, выпадет ли осадок, если к 40 мл раствора хлорида стронция c С(SrCl2) = 0,005 моль/л прилить 60 мл раствора фосфата натрия c С(Na3PO4) = 0,0001 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Zn(OH)2 из раствора сульфата цинка с С(ZnSO4) = 0,01 моль/л при добавлении щелочи. Вариант №15 1. Растворимость CaC2O4 равна 5,7×10-3 г/л. Найти 2. Рассчитать концентрацию Ag3AsO3 в насыщенном растворе в моль/л и в г/л. 3. Определить, выпадет ли осадок, если к раствору нитрата серебра с С(AgNO3) = 0,0008 моль/л добавить равный объем раствора Na2S с С(Na2S) = 0,0009 моль/л. 4. Определить, как и во сколько раз изменится растворимость цианида меди (I) при подкислении раствора до рН = 5, если
Вариант №16 1. Для растворения 1 г PbI2 требуется 1720 мл воды. Принимая объем раствора равным объему воды, вычислить 2. Рассчитать концентрацию карбоната стронция в насыщенном растворе в моль/л и в г/л. 3. Определить, выпадет ли осадок при сливании 25 мл раствора сульфата калия с С(K2SO4) = 0,001 моль/л и 75 мл раствора хлорида стронция с С(SrCl2) = 0,01 моль/л. 4. Определить, как и во сколько раз отличается растворимость фосфата кальция в воде и в растворе хлорида кальция c С(CaCl2) = 0,01 моль/л. Вариант №17 1. Растворимость Ag2SO4 равна 1,7×10-2 моль/л. Найти 2. Рассчитать массу ионов Ag+ в 10 л насыщенного раствора AgIO3. 3. Найти минимальную концентрацию раствора сульфата натрия, чтобы при добавлении 20 мл его к 80 мл раствора нитрата свинца с С(Pb(NO3)2) = 0,0006 моль/л выпал осадок. 4. Определить растворимость карбоната бария в воде, в растворе хлорида бария c С(BaCl2) = 0,01 моль/л и в воде, подкисленной до рН = 5. Для угольной кислоты: Вариант №18 1. Концентрация карбонат-анионов в насыщенном растворе Ag2CO3 составляет 1,3×10-4 моль/л. Вычислить 2. Рассчитать растворимость карбоната свинца в насыщенном растворе моль/л и в г/л. 3. Определить, выпадет ли осадок, если к 60 мл раствора хлорида кальция c С(CaCl2) = 0,001 моль/л прилить 40 мл раствора фосфата натрия c С(Na3PO4) = 0,0005 моль/л. 4. Найти минимальное значение рН, соответствующее началу выпадения осадка Ni(OH)2 из раствора сульфата никеля с С(NiSO4) = 0,01 моль/л при добавлении щелочи. БЛОК ИНФОРМАЦИИ КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Представления о комплексных (координационных) соединениях возникли в связи с необходимостью объяснить строение веществ, в которых повышение числа связей (валентности) у некоторых ионов или атомов не сопровождалось увеличением заряда или степени окисления. Важнейшую роль в химии координационных соединений сыграла теория, созданная в 1893 г. швейцарским химиком А. Вернером. Дальнейшее развитие теория комплексных соединений получила уже в 20-м веке. Это было обусловлено тем, что к разряду комплексных стали относить соединения, которые ранее традиционно считались простыми. Так, до настоящего времени нет четкой границы между комплексными соединениями и двойными солями или кристаллогидратами. Другой причиной для более детального изучения комплексных соединений послужили работы Шварценбаха и Пршибила. Предло-женный ими метод комплексонометрии - титриметрический метод анализа, основанный на образовании устойчивых комплексных соединений металлов - нашел широкое применение в химическом анализе. Наконец, следует отметить, что комплексные соединения играют большую роль и в биохимических процессах. Действительно, гемоглобин, хлорофилл, витамин B12 и многие другие биологически важные соединения относятся к разряду комплексных. Последнее особенно важно: будущему врачу необходимо четко представлять химизм протекающих в организме человека процессов, в большинстве из которых участвуют комплексные соединения.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 719; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.188.152 (0.014 с.) |

 CaTr2- + 2H+
CaTr2- + 2H+

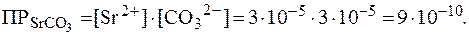
 .
. 2Ag+ + CrO42-.
2Ag+ + CrO42-. .
.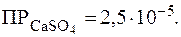 Найти растворимость CaSO4 в моль/л и г/л.
Найти растворимость CaSO4 в моль/л и г/л.

 (см. таблицу 1), n = 1, m = 2, то уравнение (2) примет вид:
(см. таблицу 1), n = 1, m = 2, то уравнение (2) примет вид:
 Растворимость сульфата свинца в насыщенном растворе найдем по формуле (2):
Растворимость сульфата свинца в насыщенном растворе найдем по формуле (2):
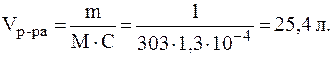
 .
.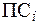 превысит значение
превысит значение  .
.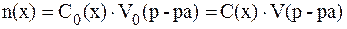 .
.
 ;
;

 .
.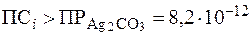 .
.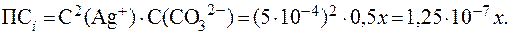
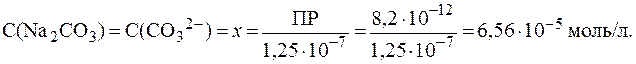
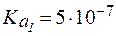 ,
,  .
. равна:
равна:



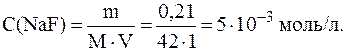
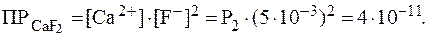



 равна:
равна:



 и ПР, получаем:
и ПР, получаем:

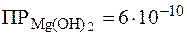 . Образование осадка Mg(OH)2 начнется при условии, что
. Образование осадка Mg(OH)2 начнется при условии, что 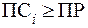 . Поэтому можно запи-сать:
. Поэтому можно запи-сать: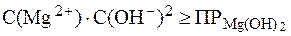 .
.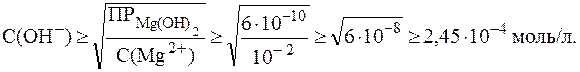
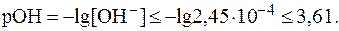
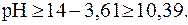
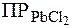 .
. .
.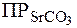 .
. .
. .
. .
. ,
,  .
. .
. ,
, 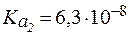 .
.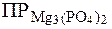 .
. .
. .
. .
. .
. .
. ,
,  .
. .
.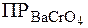 .
. .
. .
. .
. .
. ,
,  .
. .
.


