Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гетерогенные и гомогенные реакции.Содержание книги Поиск на нашем сайте Для обратимых экзотермических реакций с повышением температуры равновесный выход продукта непрерывно уменьшается, а действительный выход увеличивается при низких температурах и уменьшается при высоких, проходя через максимум при оптимальной температуре. Абсолютное значение максимального выхода и соответствующее ему значение оптимальной температуры изменяются в зависимости от активности катализатора, концентрации реагирующих веществ и других условий процесса, но оптимальная температура всегда понижается с увеличением степени превращения. Эти закономерности справедливы для всех простых обратимых экзотермических газовых реакций, в частности для промышленных каталитических процессов: гидрирования, окисления, гидратации и подобного, для реакций синтеза аммиака, каталитического окисления SO2, конверсии оксида углерода, окисления этилена в оксид этилена и др. Сложным может быть влияние температуры на каталитические процессы, в которых повышение температуры до некоторого предела вызывает протекание вредных побочных реакций (например, для синтеза метанола и эталона, окисления аммиака и др.). При этом необходимо анализировать влияние температуры на каждую реакцию в отдельности. По фазовому состоянию реагентов реакции бывают гомогенные (однородные) и гетерогенные (неоднородные). В гомогенных реакциях все взаимодействующие вещества находятся в одной фазе (газовой, жидкой или твердой). Зоной реакции при проведении гомогенных реакций служит весь реакционный объем. В гетерогенных процессах реагенты, принимающие участие в реакции, находятся в разных фазах. В реакционном объеме одновременно находятся две или более фазы, а химическая реакция протекает на границе раздела фаз или в объеме одной из фаз. Гетерогенные двухфазные реакции в зависимости от агрегатного состояния исходных веществ бывают следующих типов: Реакция сжигания угля служит примером гетерогенной реакции в системе «газ – твердое тело». Твердая фаза – углерод, взаимодействуя с газообразным кислородом, дает газообразный продукт реакции – углекислый газ. Примером реакции между несмешивающимися жидкостями может служить реакция нитрования толуола азотной кислотой, в которой оба исходных вещества являются взаимонерастворимыми жидкостями. Примером реакции в системе «газ – жидкость» является реакция поглощения ангидрида водой с образованием жидкой серной кислоты. Реакция между серной кислотой и окисью меди служит примером гетерогенной реакции «жидкость – твердая фаза». Гетерогенные системы бывают также трехфазными. Скорость реакции в момент τ – мгновенная скорость V τ – подчиняется закону действующих масс, который был экспериментально открыт и теоретически обоснован в середине XIX столетия и получил свое название от термина «действующая масса» – синонима современного понятия «концентрация». Рассмотрим взаимодействие молекулы А с молекулой В в неком объеме Пусть реакция происходит в некоторой точке R через предшествующее взаимодействию столкновение. Если молярные концентрации веществ А и В выразить через их символы в квадратных скобках, то вероятность нахождения веществ А в точке R будет пропоциональна [A], т. е. ωA=α[A]. Вероятность ωB нахождения вещества в этой точке равна ωB = β[B], а вероятность их одновременного присутствия в точке R (точке столкновения) равна произведению ωA∙ωВ = α[A]∙β[B]. Поскольку только часть столкновений приводит к химической реакции, то скорость реакции образования АВ равна V AB = γ∙α[A]∙β[B] = γ α β [A] [B]. Обозначив γ·α·β = k, получаем для реакции A + B, V AB = k [A] [B] Коэффициент пропорциональности называют константой скорости. Очевидно, для реакции a A + b B, то есть для a молей вещества А и b молей вещества В ЗДМ формально запишется в виде
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях их стехиометрических коэффициентов. Это определение относится к гомогенным реакциям. Если реакция геторогенная (реагенты находятся в разных агрегатных состояниях), то в уравнениие ЗДМ входят только жидкие или только газообразные реагенты, а твердые исключаются, оказывая влияние только на константу скорости k. Константа скорости k численно равна скорости, если концентрации реагентов постоянны и равны единице.
Билет№12 Химическое и фазовое равновесие. Смещение химического равновесия. Принцип Ле-Шателье. Равнове́сие фаз в термодинамике — состояние, при котором фазы в термодинамической системе находятся в состоянии теплового, механического и химического равновесия. Типы фазовых равновесий: Тепловое равновесие означает, что все фазы вещества в системе имеют одинаковую температуру. Механическое равновесие означает равенство давлений по разные стороны границы раздела соприкасающихся фаз. Строго говоря, в реальных системах эти давления равны лишь приближенно, разность давлений создается поверхностным натяжением. Химическое равновесие выражается в равенстве химических потенциалов всех фаз вещества. Перевод равновесной химической системы из одного состояния равновесия в другое называется смещением (сдвигом) химического равновесия, которое осуществляется изменением термодинамических параметров системы - температуры, концентрации, давления При смещении равновесия в прямом направлении достигается увеличение выхода продуктов, а при смещении в обратном направлении - уменьшение степени превращения реагента. И то, и другое может оказаться полезным в химической технологии. Направление сдвига химического равновесия определяется принципом Ле-Шателье: если на систему в состоянии истинного равновесия воздействовать извне, изменяя термодинамические параметры, то равновесие сместится в том направлении, которое ослабит эффект внешнего воздействия. Влияние температуры на состояние равновесия различно для эндотермических (DН° > 0) и экзотермических (DН°< 0) реакций. В соответствии с принципом Ле-Шателье изменение температуры смещает направление этих реакций (показано стрелкой), тем самым уменьшая эффект внешнего воздействия на систему: повышение температуры А D В; DН° > 0 (®) (нагревание) В D А; DН° < 0 () понижение температуры А D В; DН° > 0 () (охлаждение) В D А; DН° < 0 (®) Например, смещение равновесия в реакции СО2(г) + Н2(г) D СО(г) + Н2О(г); DН° = + 41 кДж При повышении температуры будет осуществляться в прямом так как реакция эндотермическая), а при понижении температуры - в обратном направлении. Этот фактор смещения равновесия применим ко всем химическим системам вне зависимости от агрегатного состояния реагентов и продуктов. Влияние концентрации на состояние равновесия ограничено изменением содержания только тех веществ, равновесные концентрации которых входят в выражение для константы равновесия. Для гомогенных реакций (5.1) в соответствии с принципом Ле-Шателье введение избытка одного из реагентов вызовет смещение равновесия в прямом, а введение избытка одного из продуктов - в обратном направлении, тем самым ослабляя эффект внешнего воздействия на систему: избыток реагента (А или В) (®) избыток продукта (С или D) () Для гетерогенных реакций введение дополнительного количества жидкого или твердого вещества (реагента или продукта) не влияет на состояние равновесия. Например, для гетерогенной реакции Cu2O(т) + 2 HCl(г) D 2 CuCl(ж) + H2O(г) Добавление в систему избытка хлороводорода сместит равновесие в прямом направлении, а ввдение избытка твердого оксида меди(I) на состояние равновесия не повлияет. Влияние давления на состояние равновесия проявляется только при наличии в системе газов. В соответствии с принципом Ле-Шателье увеличения давления смещает равновесие в сторону той (прямой или обратной) реакции, которая сопровождается уменьшением объема (газообразных продуктов или реагентов соответственно). А уменьшение давления - в противоположную сторону. Поскольку объем газообразных реагентов и продуктов пропорционален сумме их стехиометрических коэффициентов (обозначенной ånреаг. и ånпрод.), то изменение давления в гомогенных реакциях (5.1) сместит равновесие в следующем направлении, тем самым уменьшая эффект внешнего воздействия на систему: увеличение ånреаг > ånпрод (®) давления ånреаг < ånпрод () уменьшение ånреаг > ånпрод ( Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление,концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном[1]. Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье)[ Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
Например, в реакции синтеза аммиака N2 + 3H2 ⇄ 2NH3 + Q тепловой эффект в стандартных условиях составляет -92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта. Билет№13 Константа химического равновесия и её связь с изменением изобарного потенциала (свободной энергией Гиббса). Выявление возможности протекания реакции в данном направлении. Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов pi по формуле[1]:
где νi — стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным). Kp не зависит от общего давления, от исходных количеств веществ или от того, какие участники реакции были взяты в качестве исходных, но зависит от температуры [2]. Например, для реакции окисления монооксида углерода: 2CO + O2 = 2CO2 константа равновесия может быть рассчитана по уравнению:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность ci, константа равновесия принимает вид:
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность fi и активность ai:
В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента (
где Δn — изменение числа молей веществ в ходе реакции. Видно, что Kx зависит от давления. Если число молей продуктов реакции равно числу молей исходных веществ ( Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпиисистемы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) Билет№14 Способы выражения состава растворов (концентрации). Способы выражения состава растворов. Основные понятия: растворимость, растворитель, растворенное вещество. Растворимость – способность вещества растворяться в том или ином растворителе. Растворитель – компонент раствора, агрегатное состояние которого не изменяется при образовании раствора. Растворенное вещество – компоненты раствора за исключением растворителя.
|
||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 1040; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.009 с.) |


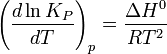
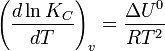
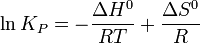
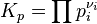
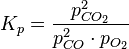
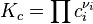

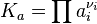
 ), тогда легко показать[2], что:
), тогда легко показать[2], что:
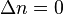 ), то
), то 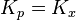 .
.