
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос№6 Второй закон термодинамикиСодержание книги Поиск на нашем сайте
Второй Закон Термодинамики, как и Первый (Закон сохранения энергии) установлен эмпирическим путем. Впервые его сформулировал Клаузиус: " теплота сама собой переходит лишь от тела с большей температурой к телу с меньшей температурой и не может самопроизвольно переходить в обратном направлении". Другая формулировка: все самопроизвольные процессы в природе идут с увеличением энтропии. (Энтропия - мера хаотичности, неупорядоченности системы). Вопрос №7 Свободная энергия (энергия Гиббса, Гельмгольца) как критерий направления химической реакции и предела её протекания. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпиисистемы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическом изотермическом процессе равна работе, совершённой системой над внешними телами. Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так: · Отсюда дифференциал свободной энергии равен: · Видно, что это выражение является полным дифференциалом относительно независимых переменных Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так: · где В соответствии с рекомендациями ИЮПАК энергию Гельмгольца в химической термодинамике можно также обозначать как A [1]. Вопрос№8 Скорость химической реакции и методы её регулирования. Зависимость скорости реакции от природы и концентрации реагентов. Закон действия масс (ЭДМ) для гомогенных и гетерогенных реакций. Количественной характеристикой того, насколько быстро протекает данная реакция, является скорость химической реакции, т. е. скорость расходования реагентов или скорость появления продуктов. При этом безразлично, о каком из участвующих в реакции веществе идет речь, поскольку все они связаны между собой через уравнение реакции. По изменению количества одного из веществ можно судить о соответствующих изменениях количеств всех остальных. Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ: V = +-((С2 – С1)/(t2 – t1)) = +-(дельта С /дельта t) где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2 соответственно (знак (+) – если скорость определяется по продукту реакции, знак (–) – по исходному веществу). Скорость реакции в данном случае обычно выражается в моль/(л•с). Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул. Скорость гетерогенной реакции выражается в моль/(м2•с). Чтобы управлять химическими реакциями, важно не только уметь определять их скорости, но и выяснить, какие условия оказывают на них влияние. Раздел химии, изучающий скорость химических реакций и влияние на нее различных факторов, называется химической кинетикой 1) Влияние концентрации реагентов
В избытке берется тот реагент: Избыток не должен сильно разбавлять реакционную смесь, нарушать теплофизические свойства реакционной смеси и тепловое регулирование реактора. Кроме того, слишком большой избыток реагента приводит к лишним экономическим затратам. Величину избытка определяют экспериментально; обычно берут избыток реагента 1,7 – 1,8 по сравнению со стехиометрией.
Скорость реакции зависит от числа столкновений молекул реагирующих веществ, а число столкновений зависит в свою очередь от числа молекул в единице объема, то есть от концентрации. С увеличением давления объем вещества уменьшается, и молекулы теснее располагаются в единице объема, то есть увеличение давление равнозначно увеличению концентрации. Особенно значителен этот эффект у газов. Жидкости и тем более твердые вещества малосжимаемы и эффект давления проявляется только в области сверхдавлений (1000 атм и выше). В случае газофазных реакций концентрации реагентов в законе действующих масс можно заменить их парциальными давлениями.
Вопрос№9 Зависимость скорости химической реакции от температуры. Правило Вант-Гоффа. 3) Влияние температуры Скорость реакции зависит не только от числа столкновений реагирующих молекул, но и от их энергии. Появление активных молекул, обладающих повышенной реакционной способностью, является результатом различных физических воздействий на вещество. При активации реагентов тем или иным способом передачи энергии увеличивается константа скорости реакции. Способы активации могут быть разные: фотохимическая, плазмохимическая, ультразвуковая и др. Наиболее часто используется термоактивация, то есть увеличение скорости реакции под воздействием температуры. Скорость химической реакции при увеличении температуры на 10 градусов возрастает в 2 - 4 раза. Это эмпирическое правило называется правилом Вант-Гоффа. Оно справедливо в области средних температур (до 4000С). Более точно влияние температуры можно описать уравнением Аррениуса:
В технологической практике обычно ставится задача повышения скорости химической реакции. Однако необходимо понимать, что вышеописанные закономерности управления скоростью химической реакции можно использовать также и для уменьшения скорости реакции, например, для подавления побочных реакций. Иногда малоконцентрированное сырье или разбавление реакционной массы растворителем или инертным газом используют для уменьшения скорости целевой реакции. Обычно это связано со сложностью организации быстрого теплоотвода в случае сильноэкзотермических реакций. Вопрос№10 Уравнение Аррениуса. Энергия активации. Влияние катализатора на скорость реакции. Механизм действия катализатора. Уравне́ние Арре́ниуса устанавливает зависимость константы скорости Согласно простой модели столкновений, химическая реакция между двумя исходными веществами может происходить только в результате столкновения молекул этих веществ. Но не каждое столкновение ведёт к химической реакции. Необходимо преодолеть определённый энергетический барьер, чтобы молекулы начали друг с другом реагировать. То есть молекулы должны обладать некой минимальной энергией (энергия активации
Здесь В рамках теории активных соударений
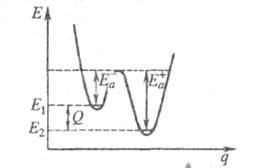
Оценки этого параметра показывают, что изменение температуры в диапазоне от 200 °C до 300 °C приводит к изменению частоты столкновений В рамках теории активированного комплекса получаются другие зависимости Уравнение Аррениуса стало одним из основных уравнений химической кинетики, а энергия активации — важной количественной характеристикой реакционной способности веществ. Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции. Потенциальный барьер - максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. Высота потенциального барьера для любого пути, проходящего через переходное состояние, равна потенциальной энергии в переходном состоянии. Если в сложной реакции, состоящей из последовательных и параллельных элементарных реакций, имеется лимитирующая элементарная реакция (реакция с максимальным характерным временем), то ее энергия активации является и энергией активации сложной реакции. В макроскопической химической кинетике энергия активации - энергетический параметр Еа, входящий в <i.Аррениуса уравнение. Любой процесс, сопровождающийся каким-либо изменением энергии, является экзотермическим в одном направлении и эндотермическим в другом. Энергия активации экзотермического и эндотермического направлений реакции, обозначаемые соотв. где Q -.теплота реакции при Т= 0. Качественная одномерная геометрическая иллюстрация связи энергии активации с высотой потенциального барьера и теплотой реакции представлена на рис., где q -координата реакции; Е1 и Е2 - уровни энергии соответственно основного состояния реагентов и продуктов реакции.
Энергетич. схема элементарной реакции. Для реакций рекомбинации свободных радикалов (в том числе и атомов), а также для широкого класса экзотермических ионно-молекулярных реакций энергия активации равна нулю или очень мала по сравнению с типичными значениями энергий хим. связей Е св. Для реакций, сопровождающихся одновременно разрывом одних и образованием других химических связей, Влияние катализатора Билет№11 Химические реакции необратимые и обратимые. Химическое равновесие. Закон действия масс для обратимых гомогенных и гетерогенных химических реакций Обратимые реакции — химические реакции, протекающие одновременно в двух противоположных направлениях (прямом и обратном), например: 3H2 + N2 ⇌ 2NH3. Направление обратимых реакций зависит от концентраций веществ — участников реакции. Так в приведённой реакции, при малой концентрации аммиака в газовой смеси и больших концентрацияхазота и водорода происходит образование аммиака; напротив, при большой концентрации аммиака он разлагается, реакция идёт в обратном направлении. По завершении обратимой реакции, т. е. при достижении химического равновесия, система содержит как исходные вещества, так и продукты реакции. Простая (одностадийная) обратимая реакция состоит из двух происходящих одновременно элементарных реакций, которые отличаются одна от другой лишь направлением химического превращения. Направление доступной непосредственному наблюдению итоговой реакции определяется тем, какая из этих взаимно-обратных реакций имеет большую скорость. Например, простая реакция N2O4 ⇌ 2NO2 складывается из элементарных реакций N2O4 ⇌ 2NO2 и 2NO2 ⇌ N2O4. Для обратимости сложной (многостадийной) реакции, например уже упоминавшейся реакции синтеза аммиака, необходимо, чтобы были обратимы все составляющие её стадии. Необратимые реакции — реакции, при которых взятые вещества нацело превращаются в продукты реакции, не реагирующие между собой при данных условиях, например, разложениевзрывчатых веществ, горение углеводородов, образование малодиссоциирующих соединений, выпадение осадка, образование газообразных веществ. Ba(ClO2)2 + H2SO4 → 2HClO2 + BaSO4↓ NaHCO3 + CH3COOH → CH3COONa + H2O + CO2↑ Однако надо понимать, что при изменении условий протекания реакции, теоретически возможно сместить равновесие любой реакции. Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 277; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.72.55 (0.009 с.) |

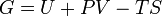
 , где
, где  — внутренняя энергия,
— внутренняя энергия,  — абсолютная температура,
— абсолютная температура,  — энтропия.
— энтропия. .
. . Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию
. Поэтому часто свободную энергию Гельмгольца для равновесного состояния выражают как функцию 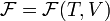 .
.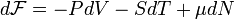 ,
, — химический потенциал, а
— химический потенциал, а  — число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция
— число частиц в системе. При этом свободная энергия Гельмгольца для равновесного состояния записывается как функция  .
.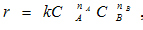 где k – константа скорости реакции, СА и СВ – текущие концентрации реагентов, nA и nB - порядок реакции по реагенту А и В соответственно.
где k – константа скорости реакции, СА и СВ – текущие концентрации реагентов, nA и nB - порядок реакции по реагенту А и В соответственно.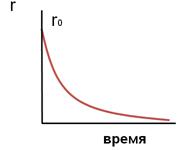
 Вполне очевидно, что, чем выше скорость химической реакции, тем меньше время достижения одной и той же величины конверсии. Поэтому при больших начальных, а, следовательно, и текущих концентрациях реагента время проведения химической реакции уменьшается.
Вполне очевидно, что, чем выше скорость химической реакции, тем меньше время достижения одной и той же величины конверсии. Поэтому при больших начальных, а, следовательно, и текущих концентрациях реагента время проведения химической реакции уменьшается.  Известно, что парциальные давления компонентов смеси пропорциональны их мольным долям.
Известно, что парциальные давления компонентов смеси пропорциональны их мольным долям. где р – общее давление, NA и NB – мольные доли компонентов А и В. Тогда
где р – общее давление, NA и NB – мольные доли компонентов А и В. Тогда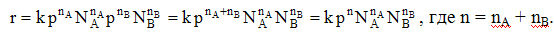 То есть скорость газофазной реакции пропорциональна давлению в степени, равной суммарному порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка. При низком значении порядка реакции повышение давления вызывает незначительное изменение скорости процесса.
То есть скорость газофазной реакции пропорциональна давлению в степени, равной суммарному порядку реакции. Изменение давления наиболее сильно влияет на реакции высокого порядка. При низком значении порядка реакции повышение давления вызывает незначительное изменение скорости процесса.
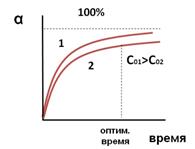
 Зависимость конверсии от давления показывает, что существует некоторое оптимальное значение давления (ропт.), выше которого рост конверсии при повышении давления очень незначителен, и поэтому использование более высоких давлений становится нецелесообразным.
Зависимость конверсии от давления показывает, что существует некоторое оптимальное значение давления (ропт.), выше которого рост конверсии при повышении давления очень незначителен, и поэтому использование более высоких давлений становится нецелесообразным. где Еа – энергия активации, Т – температура, R – газовая постоянная, k0 – предэкспоненциальный множитель, зависящий только от природы реагирующих частиц.
где Еа – энергия активации, Т – температура, R – газовая постоянная, k0 – предэкспоненциальный множитель, зависящий только от природы реагирующих частиц.

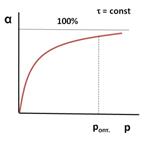
 При низких температурах мала скорость процесса, поэтому невелик подъем кривой α = f (T). По мере повышения температуры скорость реакции увеличивается по экспоненте, что приводит к резкому подъему кривой. Но с увеличением степени превращения реагентов снижается их концентрация, а, следовательно, и скорость процесса, поэтому функциональная зависимость α = f (T) асимптотически приближается к единице.
При низких температурах мала скорость процесса, поэтому невелик подъем кривой α = f (T). По мере повышения температуры скорость реакции увеличивается по экспоненте, что приводит к резкому подъему кривой. Но с увеличением степени превращения реагентов снижается их концентрация, а, следовательно, и скорость процесса, поэтому функциональная зависимость α = f (T) асимптотически приближается к единице. химической реакции от температуры
химической реакции от температуры 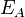 ), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией
), чтобы этот барьер преодолеть. Из распределения Больцмана для кинетической энергии молекул известно, что число молекул, обладающих энергией  , пропорционально
, пропорционально  . В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусомиз термодинамических соображений:
. В результате скорость химической реакции представляется уравнением, которое было получено шведским химиком Сванте Аррениусомиз термодинамических соображений:
 характеризует частоту столкновений реагирующих молекул,
характеризует частоту столкновений реагирующих молекул, 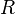 — универсальная газовая постоянная.
— универсальная газовая постоянная.
 где к - константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости ln k от 1 /kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся).
где к - константа скорости. А - предэкспоненциальный множитель (постоянная или слабо зависящая от температуры величина); k - константа Больцмана; Т - абсолютная температура. График зависимости ln k от 1 /kT (аррениусов график) - прямая линия. Наблюдаемая энергия активации вычисляется из тангенса угла наклона этой прямой. В общем случае сложных реакций параметр Еа в уравнении Аррениуса является функцией энергии активации отдельных стадий, и определяемая энергия активации называется эффективной (эмпирической, кажущейся). и
и  , связаны соотношением:
, связаны соотношением: 
 составляет обычно от сотых до десятых долей Е св, если среди реагентов есть свободные радикалы, и сравнима с Е св , если реагенты - химически насыщенные молекулы.
составляет обычно от сотых до десятых долей Е св, если среди реагентов есть свободные радикалы, и сравнима с Е св , если реагенты - химически насыщенные молекулы. 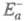 может быть аномально большой (например, больше энергии возбуждения атома Е *) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А
может быть аномально большой (например, больше энергии возбуждения атома Е *) в реакциях тушения электронного возбуждения при столкновениях атомов: А + А  А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.
А + А, если точка пересечения термов реагентов и продуктов реакции расположена высоко по сравнению с Е* или термы не пересекаются.


