
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос. Равновесие в системе раствор - осадок. Константа растворимости и ее значение.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Константа равновесия. Характеризует обратимую химическую реакцию. Если записать для рассмотренной обратимой реакции A + D Для газообразных соединений константу равновесия выражают через давление; Выражение константы равновесия: Он гласит: для идеальных систем в состоянии химического равновесия отношение произведений концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению концентраций исходных веществ, в степенях, равных стехиометрическим коэффициентам, есть величина постоянная при данных температуре, давлении и в данном растворителе. Вопрос. Факторы, влияющие на растворимость осадков. Условия выпадения осадка. На растворимость осадка оказывают влияние следующие факторы. 1. Изменение рН растворов. 2. Присутствие аммонийных солей сильных кислот в растворах гидроксидов, оксикарбонатов. 3. Присутствие комплексообразователей в растворах малорастворимых солей. 4. Присутствие посторонних ионов, не входящих в состав малорастворимого соединения (солевой эффект), и другие факторы. 5. Присутствие окислителей или восстановителей в растворах малорастворимых соединений. 6. Изменение температуры. 7. Влияние растворителя. Условия выпадения осадка. Осадок образуется,если произведение ионов в растворе(ИП)больше или равно произведению растворимости. ИП ИП Вопрос. Способы выражения концентраций растворов в титриметрии. Эквивалент, молярная масса эквивалента, способы выражения долей. Молярная концентрация С (Х):
Молярная масса:
Нормальная концентрация
Эквивалент реальная(условная) частица вещества,которая эквивалентна. т.е. каким-либо химическим образом связана с ионами водорода или электронами в ОВР. Молярная масса эквивалента:
Способы выражения долей: проценты (%) – коэффициент 102 - промилле (ppt) - коэффициент 103 - миллионные доли (ppm) – коэффициент 106 - миллиардные доли (ррb) – коэффициент 109
Вопрос. Методы титриметрического анализа. Требования, предъявляемые к реакции в титриметрическом анализе. 1. Нейтрализация: определяют кол-во кислот, оснований а также некоторых солей. 2. Окисления-восстановления (оксидиметрия). Эти методы основаны на реакциях окисления-восстановления. При помощи растворов окислителей определяют количества веществ, являющ. Восстановителями и наоборот. 3. Осаждения и комплексообразования, основанные на осаждении ионов в виде труднорастворимых соединений и на связывании ионов в малодиссоциированный комплекс. 4. Прямое титрование состоит в том, что пробу анализируемого вещества титруют стандартным раствором, или титрантом, до точки эквивалентности — момента, когда количество стандартного раствора эквивалентно кол-ву определяемого вещества в соответствии с уравнением химическим для данной реакции. Конец титрования устанавливают визуально по изменению окраски вводимого индикатора либо инструментально. Чем более точно определена точка эквивалентности, тем меньше ошибка анализа. Расчёт ведут по формуле: Р = 0,0001×N × v × Э, где Р — вес (масса), Э —число грамм-эквивалентов определяемого вещества, N — нормальность, v — объём (в мл) стандартного раствора. 5.Титрование обратное, или по остатку, применяют, когда определяемое вещество не реагирует со стандартным раствором или реагирует недостаточно быстро. В этом случае к пробе анализируемого вещества прибавляют заведомый избыток стандартного раствора и остаток его после реакции с определяемым веществом титруют др. стандартным раствором. 6.Титрование по замещению применяют, когда непосредственное определение данного вещества затруднительно (отсутствует подходящий титрант, нет необходимого индикатора и т. д.). В этом случае анализируемое вещество посредством реакции с неопределённым избытком соответствующего реагента переводят в др. соединение, которое титруют стандартным раствором, как это было описано выше. Например, этим методом определяют количество бихромата калия в растворе. Требования: Правильность, воспроизводимость, точность, предел обнаружения, чувствительность,избирательность (селективность), экспрессность, простота исполнения,экономичность, производительность,локальность,автоматизация, дистанционность.
Уравнение химической реакции: Zх ∙ Х + ZR ∙ R → Р Принцип эквивалентности: n(1/Zx*X)=n(1/ZR*R) Основное уравнение титриметрии: C(1/Zx*X)*V(X)=C(1/ ZR *R)*V(R) 26 вопрос. Виды титриметрических определений. Приемы титрования. кислотно-основное титрование — реакции нейтрализации; окислительно-восстановительное титрование (перманганатометрия, иодометрия, хроматометрия) — окислительно-восстановительные реакции; осадительное титрование (аргентометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе; Комплексонометрическое титрование — реакции, основанные на образовании прочных комплексных соединений ионов металлов с комплексоном (обычно ЭДТА), при этом изменяются концентрации ионов металлов в титруемом растворе. Приемы: В методах прямого титрования определяемое вещество непосредственно реагирует с титрантом. Для проведения анализа этим методом достаточно одного рабочего раствора. В методах обратного титрования (или, как их еще называют, методах титрования по остатку) используются два титрованных рабочих раствора: основной и вспомогательный. Например, обратное титрование хлорид-иона в кислых растворах. К анализируемому раствору хлорида сначала добавляют заведомый избыток титрованного раствора нитрата серебра (основного рабочего раствора). При этом происходит реакция образования малорастворимого хлорида серебра: Ag+ + Cl- → AgCl. Не вступившее в реакцию избыточное количество AgNO3 оттитровывают раствором тиоцианата аммония (вспомогательного рабочего раствора): Ag+ + SCN- → AgSCN. Третьим основным видом титриметрических определений является титрование заместителя (титрование по замещению, косвенное титрование). В этом методе к определяемому веществу добавляют специальный реагент, вступающий с ним в реакцию. Один из продуктов взаимодействия затем оттитровывают рабочим раствором. Например, при иодометрическом определении меди к анализируемому раствору добавляют заведомый избыток KI. Происходит реакция 2Cu2+ + 4I- → 2CuI + I2. Выделившийся иод оттитровывают тиосульфатом натрия.
|
||||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 693; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.216.192 (0.011 с.) |

 C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k 1[A]равн[B]равн = k 2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k 1/ k 2 = К, то величина К называется константой равновесия химической реакции.
C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k 1[A]равн[B]равн = k 2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k 1/ k 2 = К, то величина К называется константой равновесия химической реакции. ПР-основное условие выпадения осадка
ПР-основное условие выпадения осадка ПР –условие раств-ти осадка.
ПР –условие раств-ти осадка.


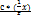 :
: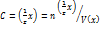 =
= 





