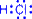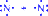Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Малорастворимые электролиты, произведение растворимости.Содержание книги
Поиск на нашем сайте
КОВАЛЕНТНАЯ СВЯЗЬ Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи. 1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций. Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность. Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль–1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла. Водородная связь - зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
Водородная связь изображена точками. Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот.
15) Тепловой эффект реакции: экзо- и эндотермические реакции; закон Гесса; (стандартная) теплота образования вещества. Экзотермическая реакция (от экзо... вне и греч. thérmó — тепло, жар), химическая реакция, сопровождающаяся выделением теплоты. Экзотермическая реакция являются, например, горение, нейтрализация, большинство реакций образования химических соединений из простых веществ. Количество выделяющейся при экзотермическая реакция теплоты зависит от массы реагентов и их природы, агрегатного состояния исходных веществ и продуктов взаимодействия, типа реакции и условий её осуществления (температуры, давления и др.). По тепловому эффекту экзотермическая реакция противоположны эндотермическим реакциям. Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данноехимическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окислениеглюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы.
На рисунке приведено схематическое изображение некоторого обобщенного химического процесса превращения исходных веществ А1, А2… в продукты реакции В1, В2…, который может быть осуществлен различными путями в одну, две или три стадии, каждая из которых сопровождается тепловым эффектом ΔHi. Согласно закону Гесса, тепловые эффекты всех этих реакций связаны следующим соотношением:
Закон открыт русским химиком Г. И. Гессом в 1840 г.; он является частным случаем первого начала термодинамикиприменительно к химическим реакциям. Практическое значение закона Гесса состоит в том, что он позволяет рассчитывать тепловые эффекты самых разнообразных химических процессов; для этого обычно используют ряд следствий из него. Восстановители Металлы, водород, уголь, Окись углерода (II) (CO).Сероводород (H2S);оксид серы (IV) (SO2);сернистая кислота H2SO3 и ее соли, Галогеноводородные кислоты и их соли. Катионы металлов в низших степенях окисления: SnCl2, FeCl2, MnSO4, Cr2(SO4)3. Азотистая кислота HNO2;аммиак NH3;гидразин NH2NH2;оксид азота(II) (NO). Катод при электролизе. Окислители Галогены. Перманганат калия(KMnO4); манганат калия (K2MnO4); оксид марганца (IV) (MnO2). Дихромат калия (K2Cr2O7); хромат калия (K2CrO4). Азотная кислота (HNO3). Серная кислота (H2SO4) конц. Оксид меди(II) (CuO); оксид свинца(IV) (PbO2); оксид серебра (Ag2O); пероксид водорода (H2O2). Хлорид железа(III) (FeCl3). Бертоллетова соль (KClO3). Анод при электролизе. Водородная энергетика. Стоимость передачи энергии в химической форме (в виде газа) значительно ниже стоимости передачи электроэнергии. В качестве носителя энергии может быть использован водород. Применение водорода значительно снизит уровень загрязнения атмосферы, так как при его окислении образуется безвредный продукт – вода
1. Основные законы и понятия в химии (законы постоянства состава, кратных отношений, Авогадро Ar, Mr, моль, эквивалент). | 2) Оксиды, типы оксидов. Методы получения, химические свойства, номенклатура основных, кислотных, амфотерных.
Окси́д(о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.Соединения, которые содержат атомы кислорода, соединённые между собой, называются пероксидами (перекисями; содержат цепочку −O−O−), супероксидами (содержат группу О−2) и озонидами (содержат группу О−3). Они не относятся к категории оксидов.В зависимости от химических свойств различают:
Солеобразующие оксиды:
основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO.
Номенклатура
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: Na2O — оксид натрия, Al2O3 — оксид алюминия. Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела). Например, Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).Также распространены исторически сложившиеся (тривиальные) названия оксидов, например угарный газ CO, серный ангидрид SO3 и т. д.
Химические свойства
При взаимодействии кислотного оксида с основным образуется соль.
Оксиды взаимодействуют с водой, если образуется растворимая кислота или растворимое основание. Основные оксиды взаимодействуют с кислотами, а кислотные с основаниями.
Основные оксиды
1. Основный оксид + сильная кислота → соль + вода
CuO + H_2SO_4 →CuSO_4 + H_2O
2. Сильно основный оксид + вода → гидроксид
{CaO + H_2O→Ca(OH)_2
3. Сильно основный оксид + кислотный оксид → соль
CaO + Mn_2O_7→Ca(MnO_4)_2
4. Основный оксид + водород → металл + вода
CuO + H_2 →Cu + H_2O
Примечание: металл менее активный, чем алюминий.
Кислотные оксиды
1. Кислотный оксид + вода → кислота
SO_3 + H_2O →H_2SO_4
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём.
2. Кислотный оксид + основный оксид → соль CO_2 + CaO→CaCO_3
3. Кислотный оксид + основание → соль + вода
SO2 + 2NaOH →Na2SO3 + H2O
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
Ca(OH)2 + CO2→CaCO3+ H_2O
CaCO_3 + H_2O + CO_2 →Ca(HCO_3)_2
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
SiO_2 + Na_2CO_3 → Na_2SiO_3 + CO_2}
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
2P_2O_5 + 4HClO_4 → 4HPO_3 + 2Cl_2O_7
Амфотерные оксиды
При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
ZnO + 2HCl →ZnCl_2 + H_2O
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
ZnO + 2KOH + H_2O → K_2[Zn(OH)_4]} (в водном растворе)
ZnO + 2KOH → K_2ZnO_2(при сплавлении)
Получение
Взаимодействие простых веществ (за исключением инертных газов, золота и платины) с кислородом:
2H_2 + O_2 →2H_2O
2Cu + O_2 → 2CuO
При горении в кислороде щелочных металлов (кроме лития), а также стронция и бария образуются пероксиды и надпероксиды: 2Na + O_2 →Na_2O_2
K + O_2 →KO_2
2. Обжиг или горение бинарных соединений в кислороде:
4FeS_2 + 11O_2 → 2Fe_2O_3 + 8SO_2
CS_2 + 3O_2 →CO_2 + 2SO_2
2PH_3 + 4O_2 → P_2O_5 + 3H_2O
3. Термическоеразложениесолей: CaCO_3 →CaO + CO_2} 2FeSO_4 → Fe_2O_3 + SO_2 + SO_3}
4. Термическое разложение оснований или кислот: 2Al(OH)_3→Al_2O_3 + 3H_2O
4HNO_3 →4NO_2 + O_2 + 2H_2O}
5. Окисление низших оксидов в высшие и восстановление высших в низшие:
4FeO + O_2 →2Fe_2O_3}
6. Взаимодействие некоторых металлов с водой при высокой температуре: Zn + H_2O →ZnO + H_2
7. Взаимодействие солей с кислотными оксидами при
сжигании кокса с выделением летучего оксида: Ca_3(PO_4)_2 + 3SiO_2 + 5C→ 3CaSiO_3 + 2P + 5CO
8. Взаимодействие металлов с кислотами-окислителями: Zn + 4HNO_3→Zn(NO_3)_2 + 2NO_2+ 2H_2O
9. При действии водоотнимающих веществ на кислоты и соли:
2KClO_4 + H_2SO_4 →K_2SO_4 + Cl_2O_7 + H_2O
10. Взаимодействие солей слабых неустойчивых кислот с более сильными кислотами:
NaHCO_3 +HCl→NaCl + H_2O + CO_2
10) Химическая связь
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества.
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Валентными углами - углами между линиями, соединяющими связываемые атомы.
Потенциал ионизации — энергия в эв (или в расчете на г атом в ккал), необходимая для отрыва одного или большего числа электронов от нейтрального атома и превращения его в положительно заряженный ион — катион.
Электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов.
Сродство к электрону. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е)
Э + е- = Э- - Е
Сродство к электрону выражается в кДж/моль или эВ/моль.
Для элементов главных подгрупп сродство к электрону возрастает в периодах слева направо и уменьшается в группах сверху вниз. Максимальное значение сродства к электрону имеет фтор.
Электроотрицательность.Способность атома, находясь в составе устойчивой молекулы, смещать к себе электронную плотность характеризуется электроотрицательностью.
Для s- и р-элементов электроотрицательность возрастает в периодах слева направо и уменьшается в группах сверху вниз. Минимальное значение сродства к электрону имеет франций, а максимальное – фтор.
41) Природные воды, водоподготовка.
Химический состав природных вод – совокупность растворенных в них минеральных и органических веществ в ионном, молекулярном и коллоидном состояниях. В природных водах растворены почти все известные на земле хим. элементы. Хим. состав делят на: главные ионы, растворимые газы, биогенные в-ва, органические в-ва, микроэлементы, загрязняющие в-ва. Факторы, определяющие состав воды: прямые(горные породы, живые организмы, обмен с другими водами, деятельность человека), косвенные(кислоты, рельеф, водный режим, растительность).
Водоподготовка. Катионы  и и 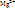 обеспечивают два вида жесткости. Вода с большим содержаниемсолей – жесткая, с малым – мягкая. Методы устранения жесткости: 1) термическая обработка, нагрев воды до 70-80 обеспечивают два вида жесткости. Вода с большим содержаниемсолей – жесткая, с малым – мягкая. Методы устранения жесткости: 1) термическая обработка, нагрев воды до 70-80  С или её кпичение, Caи Mgосаждаются в виде соединений: С или её кпичение, Caи Mgосаждаются в виде соединений:  , ,  ; 2) химическая обработкаразными хим. в-вами, карбонатную жесткость можно устранить добавлением гашёной извести: ; 2) химическая обработкаразными хим. в-вами, карбонатную жесткость можно устранить добавлением гашёной извести:  , ,  ; 3)ионный обмен, в воду добавляют твердые в-ва, которые имеют свободные ионы и катионы, способные замещаться на ионы и катионы внешней среды: ; 3)ионный обмен, в воду добавляют твердые в-ва, которые имеют свободные ионы и катионы, способные замещаться на ионы и катионы внешней среды:  , где R-частица натрия; 4) физический методоснован на явлении направленного движения ионов электролита по электродам; 5) магнитно-ионизационный методоснован на направленном движении электронов под действием магнитного поля.
12)Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные. Параметры системы.
Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела.
В зависимости от свойств поверхности раздела, термодинамические системы делятся на изолированные, закрытые и открытые.
Изолированные системы не могут обмениваться с окружающей средой ни веществом, ни энергией. Закрытые системы обмениваются с внешним миром только энергией, а открытые – и веществом, и энергией.
Если между отдельными частями системы не существует физических, т.е. реальных границ раздела, то такие системы называются гомогенными(однородными). Свойства данных систем, находящихся в состоянии равновесия, одинаковы во всех их точках.
Существуют также системы, между отдельными частями которых имеются границы раздела. При переходе через них многие свойства меняются скачкообразно. Такие системы называются гетерогенными.
Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими параметрами. Они могут быть микроскопическими и макроскопическими.
Совокупность значений размеров и масс всех частиц (молекул либо ионов), составляющих систему, их положений в пространстве, скоростей движения и т.д. называется набором микроскопических параметров.
Величины, характеризующие всю систему в целом (давление, объем, температура, масса, плотность и т.д.) называются макроскопическими параметрами.
Некоторые макроскопические параметры системы (масса, внутренняя энергия) могут быть заданы как сумма соответствующих микроскопических параметров.
Экстенсивными называются такие параметры, значения которых для всей системы равны сумме значений этих же параметров для отдельных частей системы (например, масса, объем).
Совокупность численных значений термодинамических параметров системы, характеризующих ее физические и химические свойства (присущие ей в данный момент времени), называется иначе состоянием системы.
Если значения параметров не меняются во времени, такое состояние системы называется равновесным. Такое состояние называется стационарным.
Изменение во времени значений одного или нескольких макроскопических параметров системы называют иначе термодинамическим процессом.
Сумму всех процессов, которые вывели систему из начального состояния, а затем вернули ее в это же состояние, называют круговым процессом или циклом.
Все процессы, встречающиеся в природе, можно разделить на самопроизвольные и несамопроизвольные.
. Термодинамические процессы подразделяются также на обратимые и необратимые, равновесные и неравновесные.
Процесс называется термодинамически обратимым, если его можно провести и в прямом, и в обратном направлении.
Реальные процессы, протекающие в природе, являются термодинамически необратимыми и неравновесными.
14) Первое (закон сохранения энергии) и второе начало термодинамики.
«Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщенного системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале , где R-частица натрия; 4) физический методоснован на явлении направленного движения ионов электролита по электродам; 5) магнитно-ионизационный методоснован на направленном движении электронов под действием магнитного поля.
12)Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные. Параметры системы.
Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела.
В зависимости от свойств поверхности раздела, термодинамические системы делятся на изолированные, закрытые и открытые.
Изолированные системы не могут обмениваться с окружающей средой ни веществом, ни энергией. Закрытые системы обмениваются с внешним миром только энергией, а открытые – и веществом, и энергией.
Если между отдельными частями системы не существует физических, т.е. реальных границ раздела, то такие системы называются гомогенными(однородными). Свойства данных систем, находящихся в состоянии равновесия, одинаковы во всех их точках.
Существуют также системы, между отдельными частями которых имеются границы раздела. При переходе через них многие свойства меняются скачкообразно. Такие системы называются гетерогенными.
Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими параметрами. Они могут быть микроскопическими и макроскопическими.
Совокупность значений размеров и масс всех частиц (молекул либо ионов), составляющих систему, их положений в пространстве, скоростей движения и т.д. называется набором микроскопических параметров.
Величины, характеризующие всю систему в целом (давление, объем, температура, масса, плотность и т.д.) называются макроскопическими параметрами.
Некоторые макроскопические параметры системы (масса, внутренняя энергия) могут быть заданы как сумма соответствующих микроскопических параметров.
Экстенсивными называются такие параметры, значения которых для всей системы равны сумме значений этих же параметров для отдельных частей системы (например, масса, объем).
Совокупность численных значений термодинамических параметров системы, характеризующих ее физические и химические свойства (присущие ей в данный момент времени), называется иначе состоянием системы.
Если значения параметров не меняются во времени, такое состояние системы называется равновесным. Такое состояние называется стационарным.
Изменение во времени значений одного или нескольких макроскопических параметров системы называют иначе термодинамическим процессом.
Сумму всех процессов, которые вывели систему из начального состояния, а затем вернули ее в это же состояние, называют круговым процессом или циклом.
Все процессы, встречающиеся в природе, можно разделить на самопроизвольные и несамопроизвольные.
. Термодинамические процессы подразделяются также на обратимые и необратимые, равновесные и неравновесные.
Процесс называется термодинамически обратимым, если его можно провести и в прямом, и в обратном направлении.
Реальные процессы, протекающие в природе, являются термодинамически необратимыми и неравновесными.
14) Первое (закон сохранения энергии) и второе начало термодинамики.
«Изменение полной энергии системы в квазистатическом процессе равно количеству теплоты Q, сообщенного системе, в сумме с изменением энергии, связанной с количеством вещества N при химическом потенциале  , и работы A', совершённой над системой внешними силами и полями, за вычетом работы А, совершённой самой системой против внешних сил»: , и работы A', совершённой над системой внешними силами и полями, за вычетом работы А, совершённой самой системой против внешних сил»:
 .
Для элементарного количества теплоты .
Для элементарного количества теплоты  , элементарной работы , элементарной работы  и малого приращения (полного дифференциала) и малого приращения (полного дифференциала)  внутренней энергии первый закон термодинамики имеет вид: внутренней энергии первый закон термодинамики имеет вид:
 .
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая – работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Второе начало термодинамики можно сформулировать какзакон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Формула Больцмана S=k•lnW дает объяснение постулируемое вторым началом термодинамики возрастанию энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Значит, формула Больцмана дает статистическое толкование второго начала термодинамики. Являясь статистическим законом, оно описывает закономерности хаотического движения огромного числа частиц, которые составляющих замкнутую систему.
Дадим еще две формулировки второго начала термодинамики: 1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу; 2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
18) Обратимые и необратимые реакции. Химическое равновесие; константа равновесия; влияние температуры на константу равновесия. Принцип Ле-Шателье.
Все химические реакции можно разбить на 2 группы: необратимые и обратимые. Необратимые реакции протекают до конца-до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же р-ция может протекать как в прямом, так и в обратном направлениях.
Zn+4HN .
Разделение работы на две части, одна из которых описывает работу, совершённую над системой, а вторая – работу, совершённую самой системой, подчёркивает, что эти работы могут быть совершены силами разной природы вследствие разных источников сил.
Второе начало термодинамики можно сформулировать какзакон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает.
Формула Больцмана S=k•lnW дает объяснение постулируемое вторым началом термодинамики возрастанию энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Значит, формула Больцмана дает статистическое толкование второго начала термодинамики. Являясь статистическим законом, оно описывает закономерности хаотического движения огромного числа частиц, которые составляющих замкнутую систему.
Дадим еще две формулировки второго начала термодинамики: 1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу; 2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
18) Обратимые и необратимые реакции. Химическое равновесие; константа равновесия; влияние температуры на константу равновесия. Принцип Ле-Шателье.
Все химические реакции можно разбить на 2 группы: необратимые и обратимые. Необратимые реакции протекают до конца-до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимая же р-ция может протекать как в прямом, так и в обратном направлениях.
Zn+4HN 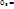 Zn Zn  +2N +2N  + +  - необратимая - необратимая  –обратимая
Когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие.
Количественной хар-кой химич. равновесия служит величина, назыв. константой химич. равновесия.
Рассмотрим ее на примере реакции синтеза йодоводорода: –обратимая
Когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие.
Количественной хар-кой химич. равновесия служит величина, назыв. константой химич. равновесия.
Рассмотрим ее на примере реакции синтеза йодоводорода:  Согласно закону действия масс, скорости прямой( Согласно закону действия масс, скорости прямой( ) и обратной( ) и обратной( ) реакций выражается уравнениями: ) реакций выражается уравнениями:
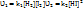 Поскольку скорости прямой и обратной реакции равны, запишем:
Поскольку скорости прямой и обратной реакции равны, запишем:  = =  или или  / /  = =  /( /( )
Отношение )
Отношение  / /  = =  , где , где  -константа равновесия данной реакции. Отсюда окончательно -константа равновесия данной реакции. Отсюда окончательно  = =  /( /( )
В общем виде, если реакция aA+bB⇆pP+qQ, то константа равновесия выразится ур.: )
В общем виде, если реакция aA+bB⇆pP+qQ, то константа равновесия выразится ур.:  = =  /( /( )
(Большие буквы обозначают формулы веществ, а маленькие-коэффициенты в уравнении реакции)
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции(числитель) и исходных веществ(знаменатель),которое устанавливается при равновесии. С увеличением температуры константа равновесия для эндотермич. реакции возрастает, для экзотермической-убывает, для Т=const остается постоянной. Влияние различных факторов на положение химич. равновесия опред. принципом Ла-Шателье:если на систему, наход. в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
20) Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированныерастворы; насыщенныйраствор.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Свойства разбавленных растворов неэлектролитов. В этих р-рах взаимодействием между растворителем и растворяемым веществом можно пренебречь. Такие р-ры можно рассматривать как результат механического перемешивания, не сопровождающегося тепловым эффектом. В таких р-рах происходит диффузия. Движущей силой диффузии является стремление компонентов р-ра к возрастанию энтропии. Осмос – односторонняя диффузия через полупроницаемую мембрану(например проникновение )
(Большие буквы обозначают формулы веществ, а маленькие-коэффициенты в уравнении реакции)
Таким образом, при постоянной температуре константа равновесия обратимой реакции представляет собой постоянную величину, показывающую то соотношение между концентрациями продуктов реакции(числитель) и исходных веществ(знаменатель),которое устанавливается при равновесии. С увеличением температуры константа равновесия для эндотермич. реакции возрастает, для экзотермической-убывает, для Т=const остается постоянной. Влияние различных факторов на положение химич. равновесия опред. принципом Ла-Шателье:если на систему, наход. в равновесии, оказать какое-либо воздействие, то в системе усиливаются процессы, стремящиеся уменьшить это воздействие.
20) Идеальные растворы. Растворы неэлектролитов: понятия диффузии и осмоса. Разбавленные и концентрированныерастворы; насыщенныйраствор.
Идеальным раствором называют раствор, для которого выполняется первый закон Рауля.
Идеальными при любых концентрациях являются растворы, компоненты которых близки по физическим и химическим свойствам и образование которых не сопровождается объёмными и тепловыми эффектами. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Свойства разбавленных растворов неэлектролитов. В этих р-рах взаимодействием между растворителем и растворяемым веществом можно пренебречь. Такие р-ры можно рассматривать как результат механического перемешивания, не сопровождающегося тепловым эффектом. В таких р-рах происходит диффузия. Движущей силой диффузии является стремление компонентов р-ра к возрастанию энтропии. Осмос – односторонняя диффузия через полупроницаемую мембрану(например проникновение  в сахарозу). Давление, которое нужно приложить к р-ру, чтобы прекратился осмос называется осмотическим. Р-ры с одинаковым осмотическим давлением называются изотопическими.Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
16) Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции: в сахарозу). Давление, которое нужно приложить к р-ру, чтобы прекратился осмос называется осмотическим. Р-ры с одинаковым осмотическим давлением называются изотопическими.Насыщенным называется раствор, который находится в динамическом равновесии с избытком растворённого вещества. Химическое равновесие – состояние системы реагирующих веществ, при котором скорости прямой и обратной реакций равны между собой.
16) Скорость реакции и факторы, влияющие на нее. Гомогенные и гетерогенные реакции. Закон действующих масс. Константа скорости реакции. Порядок и молекулярность реакции. Правило Вант-Гоффа
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то полученное значение умножается на −1.
Например, для реакции: выражение для скорости будет выглядеть так выражение для скорости будет выглядеть так  Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:природа реагирующих веществ, наличие катализатора,температура (правило Вант-Гоффа),давление,площадь поверхности реагирующих веществ.ГОМОГЕННЫЕ РЕАКЦИИ, хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. разложениеоксида азота 2N2O5 -> 4NO2 + О2; хлорирование метана СН4 + С12 -> СН3С1 + НС1; горение этана 2С2Нб + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ, хим. р-ции с участием в-в, находящихся в разл. фазах и составляющих в совокупности гетерог. систему. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 ->СаО+ СО2)
восстановлениеожсидов металлов водородом или углеродом (напр., РЬО+С>Рb+СО), растворение металлов в к-тах (напр.,Zn+H2SO4 ->ZnSO4 +Н2),взаимод. твердых реагентов (Аl2О3 + NiO -> NiAl2O4).Закон действующих масс – скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В –>продукты реакции этот закон выражается уравнением:
v Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:природа реагирующих веществ, наличие катализатора,температура (правило Вант-Гоффа),давление,площадь поверхности реагирующих веществ.ГОМОГЕННЫЕ РЕАКЦИИ, хим. р-ции, протекающие полностью в одной фазе. Примеры гомогенных реакций в газовой фазе: термич. разложениеоксида азота 2N2O5 -> 4NO2 + О2; хлорирование метана СН4 + С12 -> СН3С1 + НС1; горение этана 2С2Нб + 7О2 -> 4СО2 + 6Н2О; образование озона в земной атмосфере ЗО2 -> 2О3.
ГЕТЕРОГЕННЫЕ РЕАКЦИИ, хим. р-ции с участием в-в, находящихся в разл. фазах и составляющих в совокупности гетерог. систему. Типичные гетерогенные реакции: термич. разложение солей с образованием газообразных и твердых продуктов (напр., СаСО3 ->СаО+ СО2)
восстановлениеожсидов металлов водородом или углеродом (напр., РЬО+С>Рb+СО), растворение металлов в к-тах (напр.,Zn+H2SO4 ->ZnSO4 +Н2),взаимод. твердых реагентов (Аl2О3 + NiO -> NiAl2O4).Закон действующих масс – скорость химической реакции пропорциональна произведению концентраций реагирующих веществ.Для одностадийной гомогенной реакции типа А+В –>продукты реакции этот закон выражается уравнением:
v  k*CA*CB, где v - скорость реакции, CAи CB – концентрации веществ А и В, моль/л, k- каэффициентпропорциональноти, называемый константой скорости реакции.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс:k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.)Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных)Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц. Реакции с молекулярностью более трёх неизвестны. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза. k*CA*CB, где v - скорость реакции, CAи CB – концентрации веществ А и В, моль/л, k- каэффициентпропорциональноти, называемый константой скорости реакции.
Физический смысл константы скорости реакции k следует из уравнения закона действующих масс:k численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/л или их произведение равно единице. Константа скорости реакции зависит от температуры, от природы реагирующих веществ, но не зависит от их концентрации.Молекулярность элементарной реакции — число частиц, которые, согласно экспериментально установленному механизму реакции, участвуют в элементарном акте химического взаимодействия.
Мономолекулярные реакции — реакции, в которых происходит химическое превращение одной молекулы (изомеризация, диссоциация и т. д.)Бимолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении двух частиц (одинаковых или различных)Тримолекулярные реакции — реакции, элементарный акт которых осуществляется при столкновении трех частиц. Реакции с молекулярностью более трёх неизвестны. Порядок реакции по данному веществу — показатель степени при концентрации этого вещества в кинетическом уравнении реакции.Правило Вант-Гоффа — эмпирическое правило, позволяющее в первом приближении оценить влияние температуры на скорость химической реакции в небольшом температурном интервале (обычно от 0 °C до 100 °C). При повышении температуры на каждые 10 градусов константа скорости гомогенной элементарной реакции увеличивается в два—четыре раза.
 ,где ,где  — скорость реакции при температуре — скорость реакции при температуре  , ,  — скорость реакции при температуре — скорость реакции при температуре  , ,  — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
21) Осмотическое давление. Законы Вант-Гоффа и Рауля.
Осмос-одностороняя диффузия через полупроницаемую мембрану (проникновение воды в сахарозе)
Давление,которое нужно приложить к раствору, чтобы прекратился осмос называется осматическим.
Растворы с одинаковымосматрическимдавлнеи, наз. изотермическими.
Пар находящийся в равновесии с жидкостью наз. Насыщенным и жидкость закипает тогда, когда давление насыщенного пары становится равным атмосферному.
Температура кипения и замерзания зависит от давления насыщенного пара
Закон Вант-Гоффа:
Осматическим давлением раствора неэлектролита пропорционально концентрации растворённого вещества и абсолютной температуре.
Pi=CRT
1-ый Закон Раулся:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества: — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
21) Осмотическое давление. Законы Вант-Гоффа и Рауля.
Осмос-одностороняя диффузия через полупроницаемую мембрану (проникновение воды в сахарозе)
Давление,которое нужно приложить к раствору, чтобы прекратился осмос называется осматическим.
Растворы с одинаковымосматрическимдавлнеи, наз. изотермическими.
Пар находящийся в равновесии с жидкостью наз. Насыщенным и жидкость закипает тогда, когда давление насыщенного пары становится равным атмосферному.
Температура кипения и замерзания зависит от давления насыщенного пара
Закон Вант-Гоффа:
Осматическим давлением раствора неэлектролита пропорционально концентрации растворённого вещества и абсолютной температуре.
Pi=CRT
1-ый Закон Раулся:
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворённого вещества:

 , ,  -растворителя
2-ой закон Рауля
Повышение температуры кипения и понижение температуры замерзания раствора неэлектролита пропорциональны молярной концентрации растворённого вещества. -растворителя
2-ой закон Рауля
Повышение температуры кипения и понижение температуры замерзания раствора неэлектролита пропорциональны молярной концентрации растворённого вещества.

 Где Э и К –эбумиоскопическая и криоскопическая постоянные, Э и К зависят от природы растворителя.
22) Растворы электролитов. Изотонический коэффициент. Теория электролитической
диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу
Диссоциация -распад на ионы.
1.Электролиты в воде распадаются на ионы, т.е. протекает электролитическая диссоциация. 2.Под действием внешнего электрического тока происходит их направленное движение.
Диссоциация-обратимый процесс,на ряду с распадом может быть ассоциация(объединение ионов в малекулы)
В растворах диссоциация происходит за счёт нагревания,что усиливает колебания ионов кристаллической решётки.
В растворе воды молекулы разрушают ионную кристаллическую решётку.
Часто диссоциация протекает ступенчато:NaHSO4àNa(^+)+HSO4(^-)àH(^+)+SO4(^-2) Степень диссоциации α=(n/N)*100% ---Отношение числа растворившихся молекул к общему числу молекул в растворе
Сильные электролиты α>30%/средние- 3%<=α<=30%/ слабые- α<3%
Слабые электролиты: *органические,* ряд неорганических кислот(H2S,H2CO3,H2SO4,HNO2,H3PO4),*слабые основания(NH4OH),*Гидроксиды металлов(кроме 1-ой и 2-ой группы)
Сильные электролиты - *Практически все растворимые соли,*ряд неорганических кислот(HBr,HJ,HNO3,H2SO4,HClO4,HClO3),*Гидроксиды металлов 1-ой А и 2-ой А групп(LiOH,KOH,NaOH)
В растворах сильных электролитов наблюдается высокая концентрация ионов,в результате чего они взаимодействуют,связываются,при этом с уменьшением заряженных частиц. изотонический коэффициент i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита
(N)
Где Э и К –эбумиоскопическая и криоскопическая постоянные, Э и К зависят от природы растворителя.
22) Растворы электролитов. Изотонический коэффициент. Теория электролитической
диссоциации Аррениуса; определение кислот, оснований, солей по Аррениусу
Диссоциация -распад на ионы.
1.Электролиты в воде распадаются на ионы, т.е. протекает электролитическая диссоциация. 2.Под действием внешнего электрического тока происходит их направленное движение.
Диссоциация-обратимый процесс,на ряду с распадом может быть ассоциация(объединение ионов в малекулы)
В растворах диссоциация происходит за счёт нагревания,что усиливает колебания ионов кристаллической решётки.
В растворе воды молекулы разрушают ионную кристаллическую решётку.
Часто диссоциация протекает ступенчато:NaHSO4àNa(^+)+HSO4(^-)àH(^+)+SO4(^-2) Степень диссоциации α=(n/N)*100% ---Отношение числа растворившихся молекул к общему числу молекул в растворе
Сильные электролиты α>30%/средние- 3%<=α<=30%/ слабые- α<3%
Слабые электролиты: *органические,* ряд неорганических кислот(H2S,H2CO3,H2SO4,HNO2,H3PO4),*слабые основания(NH4OH),*Гидроксиды металлов(кроме 1-ой и 2-ой группы)
Сильные электролиты - *Практически все растворимые соли,*ряд неорганических кислот(HBr,HJ,HNO3,H2SO4,HClO4,HClO3),*Гидроксиды металлов 1-ой А и 2-ой А групп(LiOH,KOH,NaOH)
В растворах сильных электролитов наблюдается высокая концентрация ионов,в результате чего они взаимодействуют,связываются,при этом с уменьшением заряженных частиц. изотонический коэффициент i (коэффициент Вант-Гоффа) – число, показывающее во сколько раз общее количество частиц в растворе больше, чем количество молекул электролита
(N)  Теория электролитической диссоциации Аррениуса согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительные (катионы) и отрицательные (анионы) заряженные ионы. Аррениус объяснил, что лишь часть электролита диссоциирует и ввел понятие степени диссоциации электролита- отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
27) Гидролиз солей: типы, константа и степень гидролиза.
Гидролиз солей-это взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Различают три вида гидролиза солей:
1)гидролиз по аниону. Соль образована сильным основанием и слабой кислотой.(Например СH3COONa)
Диссоциация соли(сильный электролит): СH3COONa→СH3COO- +Na+
Диссоциация воды:H2O↔H++OH-
Сумируя данные уравнения, получаем уравнение гидролиза соли в ионном виде:
CH3COO- +H2O↔CH3COOH+OH-
Данное уравнение показывает, что идёт накопление гидроксид-ионов, а потому раствор приобретает щелочную реакцию.
2)Гидролиз по катиону. Соль образована сильной кислотой и слабым онованием.(Например NH4CL):
NH4CL→NH4++CL-
H2O↔H++OH-
NH4++H2O↔NH4OH+H+
В данном случае реакция раствора кислая, т.к. происходит накопление ионовH+.
3)Гидролиз по катиону и аниону. Соль образована слабыми кислотой и основанием.(Например СH3COONH4):
СH3COONH4→СH3COO -+NH4+
H2O↔H++OH-
СH3COONH4+H20↔СH3COOH+NH4OH
В данном случае степень гидролиза солей не зависит от разбавления и кислотность водных растворов солей может принимать различн
Теория электролитической диссоциации Аррениуса согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительные (катионы) и отрицательные (анионы) заряженные ионы. Аррениус объяснил, что лишь часть электролита диссоциирует и ввел понятие степени диссоциации электролита- отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе.
27) Гидролиз солей: типы, константа и степень гидролиза.
Гидролиз солей-это взаимодействие ионов соли с водой, приводящее к образованию слабого электролита. Различают три вида гидролиза солей:
1)гидролиз по аниону. Соль образована сильным основанием и слабой кислотой.(Например СH3COONa)
Диссоциация соли(сильный электролит): СH3COONa→СH3COO- +Na+
Диссоциация воды:H2O↔H++OH-
Сумируя данные уравнения, получаем уравнение гидролиза соли в ионном виде:
CH3COO- +H2O↔CH3COOH+OH-
Данное уравнение показывает, что идёт накопление гидроксид-ионов, а потому раствор приобретает щелочную реакцию.
2)Гидролиз по катиону. Соль образована сильной кислотой и слабым онованием.(Например NH4CL):
NH4CL→NH4++CL-
H2O↔H++OH-
NH4++H2O↔NH4OH+H+
В данном случае реакция раствора кислая, т.к. происходит накопление ионовH+.
3)Гидролиз по катиону и аниону. Соль образована слабыми кислотой и основанием.(Например СH3COONH4):
СH3COONH4→СH3COO -+NH4+
H2O↔H++OH-
СH3COONH4+H20↔СH3COOH+NH4OH
В данном случае степень гидролиза солей не зависит от разбавления и кислотность водных растворов солей может принимать различн
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 441; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.014 с.) |