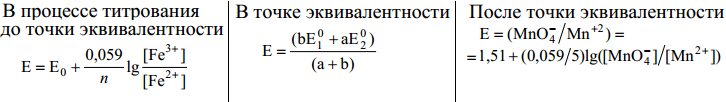Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вопрос. Особенности механизма окислительно-восстановительных реакций.Содержание книги
Поиск на нашем сайте
Окислительно-восстановительные реакции (ОВР) происходят с изменением степени окисления атомов, входящих в состав реагирующих веществ. При окислении веществ степень окисления элементов возрастает, при восстановлении - понижается. Особенности:
Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод. 1. В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. 2. В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки — в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления. Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса. Вопрос. Окислительно-восстановительные индикаторы Редокс- или окислительно-восстановительные индикаторы изменяют цвет в зависимости от присутствия в растворе окислителей или восстановителей. Дифениламин бесцветен в восстановленной форме, но имеет фиолетовый цвет в окисленном состоянии. Некоторые ярко окрашенные вещества сами могут служить индикатором. Например, при перманганатометрическом определении железа(II) 10FeSO4 + 2KMnO4+ 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O добавляемый в процессе титрования раствор перманганата обесцвечивается, пока не будут окислены все ионы Fe2+, имевшиеся в исследуемом растворе. Точка эквивалентности определяется по розовой окраске раствора, из-за возникшего избытка перманганат-анионов. Хингидрон также является окислительно-восстановительным индикатором. это смесь хинона и гидрохинона.. 2,2 - Дипиридил (комплекс с рутением) в разб HNO3: Цвет окисл формы не имеет, Цвет восст.формы - желтый. Нитро-о-фенантролин (нитроферроин), комплекс с Fe2. Цвет окисл.формы бледноголубой, Цв. Восст. Красный Вариаминовый синий 0,5% р-р HCl соли: Цвет окисл формы фиолетовый Цв. Восст. Не имеет.
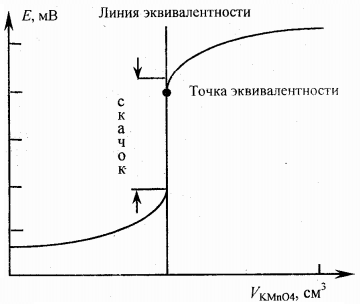
Вопрос. Окислительно-восстановительное титрование. Методология построения кривых титрования. Методы окислительно-восстановительного (ОВ) титрования или red-ox-методы – это титриметрические методы, основанные на использовании окислительно-восстановительных реакций. Обычно их классифицируют следующим образом. 1 По характеру титранта: – оксидиметрические – методы определения восстановителей с применением титранта- окислителя; – редуктометрические – методы определения окислителя с применением титранта-восстановителя. 2 По природе реагента (титранта), взаимодействующего с определенным веществом: – KMnO4 – перманганатометрия; – KBrO3 – броматометрия; – KI, Na2S2O3 – иодометрия; – I2 – иодиметрия; – Br2 – бромометрия; – Ce(SO4)2 – цериметрия. Требования к ОВР: - реакция должна протекать практически до конца; - ОВР идет тем полнее, чем больше константа равновесия. При значении K>>10^8 реакция протекает не менее, чем на 99,99%; - реакция должна протекать стехиометрически, побочные процессы должны быть исключены; - конечная точка титрования должна определяться точно и однозначно, либо с индикаторами, либо без них. В ОВ титровании применяется прямое, обратное и заместительное титрование. Процесс окислительно-восстановительного титрования можно изобразить графически как измене- ние окислительно-восстановительного потенциала Е раствора в процессе титрования. Для реакции
На основании этих данных строят кривую титрования:
|
||||
|
Последнее изменение этой страницы: 2016-07-16; просмотров: 313; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.108 (0.005 с.) |

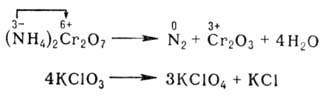 Многие окислительно-восстановительные реакции (ОВР) – каталитические, сопровождаются большим выделением энергии, бывают межмолекулярные и внутримолекулярные, большинство идут медленно, в несколько стадий. При составлении уравнений реакций окисления-восстановления основная трудность заключается в подборе коэффициентов.
Многие окислительно-восстановительные реакции (ОВР) – каталитические, сопровождаются большим выделением энергии, бывают межмолекулярные и внутримолекулярные, большинство идут медленно, в несколько стадий. При составлении уравнений реакций окисления-восстановления основная трудность заключается в подборе коэффициентов.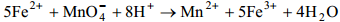 рассчитаем потенциал Е:
рассчитаем потенциал Е: