
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетические уравнения простых и сложных реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Кинетическими называют уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций. Кинетические уравнения составляют на основе закона действующих масс (Гульдберг и Вааге, 1867): скорость химических реакций прямо пропорциональна произведению концентраций реагирующих веществ, возведенных в некоторые показатели степени. Математическое выражение закона действующих масс для условной реакции: аА + bВ + cС → Р записывается следующим образом:
где k — константа скорости, являющаяся фундаментальной кинетической характеристикой реакций. Она зависит от температуры и природы веществ и не зависти от их концентрации; [A], [B], [C] — концентрации реагирующих веществ, моль/л; x, y и z — порядок реакции по веществам. Общий порядок реакции (n) равен: n = x + y + z. Порядок реакции определяется только экспериментально. Он является величиной формальной и может принимать любые значения: положительные, отрицательные, целые, дробные, а также 0. Например, для радикальной реакции H2 + Br2 → 2 HBr кинетическое уравнение записывается следующим образом: Только для простых реакций порядок и молекулярность совпадают. Так, для реакции H2 + I2 → 2 HI, кинетическое уравнение имеет вид:
Кинетическое описание простых реакций 1) Реакции нулевого порядка (n = 0).К нимотносятсяфотохимические, каталитические и ферментативные реакции (при высокой концентрации субстрата), то есть такие реакции, скорость которых не зависит от концентрации реагирующих веществ (рисунок 21).
Рисунок 21. — Кинетическая кривая реакций нулевого порядка
Условное уравнение реакции нулевого порядка: А ® Р. Кинетическое уравнение: Константа скорости рассчитывается по уравнению:
Время полуреакции (τ½) — это время, необходимое для уменьшения концентрации исходного вещества в два раза. Для реакций нулевого порядка оно составляет:
2) Реакции первого порядка (n = 1). К ним относятся каталитические и ферментативные реакции (при низкой концентрации субстрата), радиоактивный распад, выведение лекарственных препаратов из организма человека (рисунок 22). Условное уравнение реакции первого порядка: А ® Р. Кинетическое уравнение:
Рисунок 22. — Кинетическая кривая реакции первого порядка
Период полураспада некоторых радионуклидов:
3) Реакции второго порядка (n = 2). К ним относятся гидролиз белков, жиров, углеводов и других биологически активных соединений. Условные уравнения реакции второго порядка: 2 А ® Р или А + В ® Р Кинетические уравнения: Константа скорости рассчитывается по уравнению: k = Время полуреакции для реакций второго порядка составляет: τ½ =
Кинетическое описание сложных реакций 1) Обратимые реакции. Условное уравнение обратимой реакции:
Кинетическое уравнение: где k1 и k2 – константы скорости прямой и обратной реакции. Параллельные реакции. Условное уравнение параллельной реакции:
Кинетическое уравнение: Например, термическое разложение калий хлората можно представить как:
3) Последовательные реакции. Условное уравнение последовательной реакции: где k1 — константа первой стадии процесса; k2 — константа второй стадии процесса. Скорость реакции равна скорости ее медленной (лимитирующей) стадии. Если лимитирующей является первая стадия процесса, то кинетическое уравнение записывается как
Влияние температуры на скорость химических реакций На рисунках 23 - 26 представлена зависимость скорости химических реакций разных типов от температуры. У большинства химических реакций скорость увеличивается при повышении температуры (рисунок 23).
Рисунок 23. — Влияние температуры на скорость большинства химических реакций
Скорость тримолекулярных реакций при повышении температуры уменьшается (рисунок 24).
Рисунок 24. — Влияние температуры на скорость тримолекулярных реакций
Скорость радикальных (цепных) реакций с ростом температуры постепенно увеличивается вплоть до достижения взрывного режима. Взрывной режим соответствует резкому увеличению скорости процесса при постоянной температуре (рисунок 25).
Рисунок 25. — Влияние температуры на скорость радикальных реа кций
Увеличение скорости ферментативных реакций с ростом температуры наблюдается приблизительно до 60оС, а затем повышение температуры приводит только к понижению скорости процесса. Такая закономерность объясняется особенностями поведения ферментов (веществ белковой природы). При повышенной температуре происходит денатурация белка и понижение каталитической активности ферментов (рисунок 26).
Рисунок 26. — Влияние температуры на скорость ферментативных реакций
Для большинства химических реакций выполняется правило Вант-Гоффа: при повышении температуры на каждые 100 скорость реакции возрастает в 2 - 4 раза. Данное правило можно представить в виде уравнения:
где Т1 и Т2 — начальная и конечная температура, γ — температурный коэффициент реакции (2 < g < 4). Для биохимических реакций 1,5 < g < 3, поэтому при повышении температуры больного до 39,50С скорость биохимических реакций возрастает в 1,13 – 1,39 раза (увеличивается на 13-19%). Значительно точнее зависимость скорости и температуры описывается уравнением Аррениуса:
где Еа — энергия активации, кДж/моль. С точки зрения теории активного комплекса, энергия активации — это энергия образования активного комплекса из реагирующих веществ. Активный комплекс — это промежуточная частица, в которой старые связи еще не полностью разорвались, а новые — не полностью образовались. Схема химической реакции: A + B активный комплекс Другими словами, химическая реакция протекает тогда, когда молекулы реагирующих веществ преодолевают энергетический барьер реакции. Энергетические изменения, имеющие место при протекании химической реакции, отображаются при помощи энергетических диаграмм (рисунок 27).
Рисунок 27. — Энергетическая диаграмма экзотермической реакции Энергия активации зависит от природы реагирующих веществ и не зависит от температуры. С повышением температуры в реакционной смеси возрастает доля активных молекул, способных преодолеть энергетический барьер химической реакции, что приводит к увеличению ее скорости. Кроме термических, существуют нетермические способы активации молекул: фотохимические, электрические и радиационные.
Лекция 10
|
|||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 3157; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.42.25 (0.008 с.) |

 = k [A]x [B]y [C]z,
= k [A]x [B]y [C]z,


 Константа скорости рассчитывается по уравнению:
Константа скорости рассчитывается по уравнению: 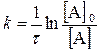
 Время полуреакции для реакций первого порядка составляет:
Время полуреакции для реакций первого порядка составляет: 
 8 дней
8 дней 27 лет
27 лет 26,6 года
26,6 года
 или τ½ =
или τ½ = 



 ,
,



 =
=  ×
× 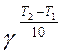 ,
, =
=  или
или  =
=  ,
,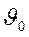 и k0 — коэффициенты пропорциональности, называемые предэкспоненциальными множителями,
и k0 — коэффициенты пропорциональности, называемые предэкспоненциальными множителями, A…B → Р
A…B → Р



