
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизмы протекания химических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Механизмом химической реакции называют последовательность и характер стадий реакции. В соответствии с механизмом различают простые и сложные реакции. Простыми (элементарными) называют реакции, протекающие в одну стадию. К простым реакциям относят диссоциацию большинства двухатомных молекул. Например: Br2 = 2Br. Сложные реакции протекают в несколько стадий. Среди сложных реакций различают: конкурирующие, последовательные, сопряженные, обратимые, цепные, фотохимические и др. 1. Конкурирующие реакции можно схематично записать так: A + B1 A + B2 Например: при нитровании фенола одновременно протекают два процесса – образование орто- и пара-нитрофенола. 2. Последовательные реакции можно записать в виде: A Примером является реакция гидролиза соли, образованной многоосновной кислотой или многокислотным основанием: Na2CO3 + H2O = NaHCO3 + NaOH; (k1); NaHCO3 + H2O = H2CO3 + NaOH; (k2). Биохимические реакции в организме человека в большинстве случаев являются последовательными. Например, глюкоза, поступающая в организм, в процессе окисления превращаясь в пировиноградную кислоту, претерпевает девять последовательных превращений (процесс гликолиза). 3. Сопряженные реакции отвечают общей схеме: a) A + B b) A + C При этом реакция (а) может протекать самостоятельно, тогда как реакция (b) протекает только при наличии реакции (а). 4. Обратимые реакции. Большинство реакций в той или иной степени обратимы, поэтому следует учитывать как прямую, так и обратную реакцию:
Например, обратимой является реакция образования аммиака: N2 + 3H2 ⇄ 2NH3. Скорость прямой реакции убывает с течением времени, а скорость обратной реакции возрастает до момента выравнивания обеих скоростей, когда наступит состояние подвижного химического равновесия. Если скорость реакции в прямом направлении значительно превышает скорость обратного процесса, то считают, что реакция протекает практически до конца. 5. Цепные реакции - это реакции, протекающие с участием химически активных частиц (свободных атомов и радикалов) и состоящие из большого количества повторяющихся стадий. Образование свободных радикалов, необходимых для начала цепной реакции, происходит при разрыве связей в молекуле и всегда бывает сопряжено с затратой энергии, которая может быть получена: а) при поглощении молекулой кванта света: Br2 б) при электрическом разряде: O2 в) под воздействием a-, b-, g-излучений (радиоактивный распад); г) при использовании внутренней тепловой энергии самой системы. Радикалы, вследствие своей валентной ненасыщенности и высокой химической активности, существуют лишь очень недолго, но они переводят устойчивые молекулы в активное состояние. Начавшаяся цепная реакция продолжается до тех пор, пока не прореагирует все вещество или пока активные частицы по каким-либо причинам не исчезнут. Роль активных радикалов могут играть атомы водорода, хлора, кислорода и группы: СН3–, –ОН, –SH, С6Н5– и др. По механизму протекания цепных реакций они делятся на неразветвленные и разветвленные. К неразветвленным цепным реакциям относятся реакции синтеза HCl(газ); НВr(газ) и другие, протекающие, например, под действием света: H2 + Cl2 Примером разветвленной цепной реакции, когда расход одной или нескольких активных частиц приводит к образованию значительно большего количества таких частиц, является реакция горения водорода (рис. 1).
Рис. 1. Схема цепной реакции горения водорода. Для зарождения цепи необходима высокая температура. Особенность развития цепи в данной реакции состоит в том, что поглощение одного радикала Актуальным является изучение цепных реакций, возникающих в организме человека при воздействии проникающей радиации, так как образующиеся радикалы способны оказывать воздействие на биологические макромолекулы (ДНК, РНК и др.), что, в свою очередь, вызывает мутации и приводит к наследственным заболеваниям. 6. Фотохимическими называются реакции, которые протекают только при наличии излучения в широком интервале энергий: от видимого и ультрафиолетового до рентгеновского и g-лучей. Энергия активации здесь обеспечивается за счет излучения, под действием которого молекулы исходных веществ переходят в электронно-возбужденное состояние. Механизмы фотохимических реакций разнообразны. Несмотря на это, во всех случаях можно выделить первичные процессы, непосредственно вызываемые действием света, и вторичные реакции, не требующие освещения для своего протекания и называемые поэтому темными. К первичным процессам относятся следующие: 1. Возбуждение молекул или атомов, в результате чего образуются менее устойчивые частицы, способные к дальнейшим превращениям: M + hn 2. Диссоциация молекул на атомы или радикалы (фотолиз): AB + hn 3. Ионизация молекул или атомов с выделением электрона (фотоэффект): M + hn Фотохимические реакции подчиняются следующим законам: I закон фотохимии: Химически активным является лишь то излучение, которое поглощается реакционной смесью. II закон фотохимии: Каждый поглощенный квант света вызывает превращение одной молекулы. Фотохимические реакции отличаются слабой зависимостью скорости реакции от температуры. Это объясняется тем, что в первичных реакциях за счет поглощения света приобретается настолько большая энергия, что повышение температуры может изменить ее лишь незначительно. Фотосинтез Фотосинтез - наиболее важный фотобиологический процесс, так как с его помощью растения и некоторые другие организмы сохраняют энергию солнечного света. Фотосинтез состоит из множества весьма сложных реакций, однако суммарный его результат выражается следующей простой реакцией: 6CO2 + 6H2O Более общая схема суммарного фотосинтетического процесса записывается следующим образом: 2H2D + CO2 где D – элемент, окисляющийся в ходе фотосинтеза. Как видно из изменения стандартной энергии Гиббса, фотосинтез относится к эндэргоническим реакциям. Эти реакции могут осуществляться только за счет поступающей извне энергии света. Зрение Зрение включает в себя поглощение энергии излучения и превращение ее в нервный импульс. Видимый свет поглощается хромофором глаза, которым служит альдегидпроизводное витамина А-ретиналь. В сетчатке глаза находится около 100 млн. специализированных клеток, так называемых палочек, и 5 млн. других клеток, называемых колбочками. Между этими клетками и нервными волокнами, соединяющими их с мозгом, находятся соединительные участки, называемые синапсами. Установлено, что в зрительном процессе поглощение энергии света не приводит ни к каким химическим реакциям, а сводится лишь к изомеризации 11-цис-ретиналя в транс-ретиналь. Ретиналь связывается с белком, называемым опсином. Опсин образует комплексы с хромофорами, формируя родопсин и йодопсин. Родопсин действует в условиях низкой интенсивности света, например, ночью. Он не различает цвета, так как содержит только один пигмент. Цветное зрение человека обусловлено йодопсином.
Ферментативный катализ Катализатором называется вещество, которое ускоряет реакцию, но само в ходе реакции не расходуется. Хотя механизмы каталитических реакций могут сильно различаться, но общим является то, что в присутствии катализатора понижается энергия активации, т. е. в присутствии катализатора процесс идет по другому пути, отличающемуся от пути реакции в отсутствие катализатора. Реакции, катализируемые ферментами, обычно характеризуются очень сильным ускорением (104 – 105 раз) и высокой специфичностью. Под специфичностью здесь понимают способность ферментов ускорять реакцию только между определенными веществами, называемыми субстратами. Ферменты бывают двух типов: простые – это белковые молекулы, содержащие один /трипсин/ или несколько /уреаза-4/ активных центров; и сложные, состоящие из белка и небелкового компонента (витамины, атомы металлов, нуклеотиды и др.). Активные центры имеют жесткую структуру, на их поверхности и происходит превращение субстратов. Ферментативный процесс можно представить следующим образом:
где E, S – фермент и субстрат; P – продукт реакции; ES – фермент-субстратный комплекс. Скорость ферментативного процесса можно рассчитать по уравнению Михаэлиса-Ментен:
где С(S) – концентрация субстрата;
Из уравнения Михаэлиса-Ментен можно сделать следующие заключения: а) при большой концентрации субстрата скорость реакции будет практически равна максимальной скорости, т. е. б) при малой концентрации субстрата скорость реакции будет прямо пропорциональна его концентрации, т. е.:
Уравнение Михаэлиса-Ментен довольно точно описывает только начальный период ферментативного процесса, так как в нем не учитывается влияние и взаимодействие с ферментом продуктов реакции. Эталоны решения задач 1. В сосуде смешали газ А количеством вещества 4,5 моль и газ В количеством вещества 3 моль. Газы А и В реагируют в соответствии с уравнением А + В = С. Через некоторое время в системе образовался газ С количеством вещества 2 моль. Какие количества непрореагировавших газов А и В остались в системе? Решение. Из уравнения реакции следует, что: Dn(A) = Dn(B) = Dn(C) = 2 моль, где Dn ‑ изменение количества вещества в ходе реакции. Следовательно, в сосуде осталось: n2(A) = n1(А) - Dn(A); n2(A) = (4,5 - 2) моль = 2,5 моль; n2(B) = n1(B) - Dn(B); n2(B) = (3 - 2) моль = 1 моль. 2. Реакция протекает по уравнению: 2A + B ⇄ C и имеет второй порядок по веществу А и первый по веществу B. В начальный момент времени скорость реакции равна 15 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 50% вещества B, если начальные концентрации равны: С(A) = 10 моль/л; С(B) = 5 моль/л. Как изменится скорость химической реакции? Решение. Согласно закону действующих масс:
С(B), вступившего в реакцию, равна: С(B) = 0,5·5 = 2,5 моль/л. Соответственно С(A), вступившего в реакцию, равна: 2 моль/л A - 1 моль/л B С(A) - 2,5 моль/л B
С(A) и С(B) после протекания реакции: С(A) = 10 - 5 = 5 моль/л, С(B) = 5 - 2,5 = 2,5 моль/л. Скорость прямой реакции будет равна:
Скорость химической реакции изменится:
т. е. уменьшится в 8 раз. 3. Реакция между веществами А и В выражается уравнением: А + 2В = С и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С(А) = 2 моль/л; С(В) = 4 моль/л; константа скорости равна 1,0. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,3 моль/л. Решение. Согласно закону действующих масс:
Если концентрация вещества А уменьшится на 0,3 моль/л, то концентрация вещества В уменьшится на 0,3×2 = 0,6 моль/л. После протекания реакции концентрации равны:
4. Скорости прямой и обратной газофазных реакций, протекающих в замкнутом сосуде, выражаются уравнениями:
Рассчитать, как изменятся скорости прямой и обратной реакций при увеличении давления в системе в 3 раза, если исходные концентрации веществ равны: С0(A) = 1 моль/л; С0(B) = 3 моль/л; С0(C) = 2 моль/л. Решение. Согласно закону действующих масс, скорости прямой и обратной реакций при начальных условиях равны:
Увеличение давления в 3 раза для газообразных систем приводит к уменьшению объема газовой смеси в 3 раза, во столько же раз увеличатся концентрации всех трех газов, и скорости обеих реакций станут соответственно равны:
Отношения скоростей реакций составляют:
Таким образом, скорость прямой реакции увеличится в 27 раз, обратной - в 9. 5. Реакция при температуре 500С протекает за 2 мин 15 с. За какое время закончится эта реакция при температуре 700С, если в данном температурном интервале температурный коэффициент скорости gравен 3? Решение. При увеличении температуры от 50 до 700С скорость реакции в соответствии с правилом Вант-Гоффа возрастает:
где Получаем:
т.е. скорость реакции увеличивается в 9 раз. В соответствии с определением, время реакции обратно пропорционально скорости протекания реакции, следовательно:
где Отсюда получаем:
Учитывая, что
6. Во сколько раз увеличится скорость химической реакции при повышении температуры от Решение. Из правила Вант-Гоффа:
Скорость реакции увеличится в 128 раз. 7. При изучении кинетики выведения лекарственного препарата из организма больного было установлено, что за 3 часа в организме пациента осталось 50% от исходного количества лекарственного средства. Определить период полувыведения и константу скорости реакции выведения препарата из организма человека, если известно, что это реакция первого порядка. Решение. Так как за данный промежуток времени из организма было выведено 50% препарата, то t1/2 = 3 часа. Константу скорости реакции рассчитаем из уравнения:
8. При лабораторных исследованиях водных растворов лекарственного средства было установлено, что вследствие гидролиза концентрация препарата за сутки уменьшилась от 0,05 моль/л до 0,03 моль/л. Вычислить период полупревращения реакции гидролиза препарата. Решение. Так как реакции гидролиза обычно протекают при значительном избытке воды, то ее концентрацию можно постоянной. Следовательно, в ходе реакции изменяется только концентрация препарата и реакцию гидролиза можно считать реакцией первого порядка. Значение константы скорости реакции найдем из уравнения:
Отсюда:
9. Период полувыведения препарата из организма больного (реакция первого порядка) равен 5 часам. Определить время, за которое из организма будет выведено 75% препарата. Решение. При выведении из организма 75% препарата отношение С/С0 составит 0,25. В данном случае удобно воспользоваться формулой:
Отсюда:
10. Константа скорости реакции гидролиза сахарозы равна 2,31×10-3 ч-1. Рассчитать: 1) период полупревращения реакции; 2) время, за которое гидролизу подвергнется 20% сахарозы; 3) какая часть глюкозы подвергнется гидролизу через 5 суток. Решение. 1. Период полупревращения равен:
2. После того, как гидролизу подвергнется 20% сахарозы, отношение С/С0 составит 0,8. Следовательно:
3. Через 5 суток (120 часов) отношение С/С0 составит:
Следовательно, гидролизу подверглось 24% глюкозы. 11. В ходе некоторой реакции первого порядка за 30 мин превращению подвергается 60% исходного количества вещества. Определить, какая часть вещества останется через 1 час. Решение. 1. Через 30 минут количество оставшегося вещества составит: С1 = С0 - 0,6С0 = 0,4×С0. т.е., отношение С0/С1 равно 2,5. 2. Найдем константу скорости реакции:
3. Количество вещества С2, оставшееся через 1 час, определим по формуле:
Таким образом, через 1 час останется 16% от исходного вещества. Вопросы для самоконтроля 1. Что называется скоростью химической реакции? 2. Что называется истинной скоростью гомогенной реакции? 3. Какова размерность скорости гомогенной реакции? 4. Что называется скоростью гетерогенной реакции? 5. Какова размерность скорости гетерогенной реакции? 6. Перечислите факторы, влияющие на скорость реакции. 7. Сформулируйте закон действующих масс. 8. Каков физический смысл константы скорости реакции? От чего зависит и от чего не зависит константа скорости реакции? 9. Что называется порядком реакции? Приведите примеры уравнений реакций нулевого, первого, второго и третьего порядков. 10. Зависит ли размерность константы скорости реакции от порядка реакции? 11. Что называется молекулярностью реакции? 12. По какой формуле можно рассчитать период полупревращения реакции первого порядка? 13. Дайте определение простым и сложным реакциям. Приведите классификацию сложных реакций. 14. Сформулируйте правило Вант-Гоффа. Приведите математическое выражение правила Вант-Гоффа. 15. Как скорость реакции зависит от энергии активации? Напишите уравнение Аррениуса. 16. Что такое активированный комплекс? Почему протекание реакций протекает через стадии образования активированных комплексов? 17. Что называется катализатором? Гомогенный и гетерогенный катализ. Почему в присутствии катализаторов реакции протекают быстрее? 18. Что такое ферментативный катализ? Напишите уравнение Михаэлиса-Ментен.
Варианты задач для самостоятельного решения Вариант № 1 1. Реакция между веществами А и В выражается уравнением 2А + В = С и имеет второй порядок по веществу А и первый по веществу B. Начальные концентрации веществ равны: С0(А) = 0,4 моль/л; С0(В) = 0,8 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,2 моль/л. 2. На сколько градусов необходимо повысить температуру, чтобы скорость реакции увеличилась в 64 раза? Температурный коэффициент скорости реакции gравен 2. 3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
а) при увеличении давления в системе в 2 раза? б) при увеличении объемов газов в 2 раза? Вариант №2 1. Реакция протекает по уравнению: A + B = C и имеет первый порядок по веществу А и по веществу B. Концентрацию A увеличили с 2 до 8 моль/л, а концентрацию B с 3 до 9 моль/л. Во сколько раз возросла скорость прямой реакции? 2. При 1500С реакция заканчивается за 10 минут. Принимая температурный коэффициент gравным 2, рассчитайте, через сколько минут закончилась бы реакция при 1700C. 3. Скорость реакции выражается уравнением: Вариант №3 1. Реакция выражается уравнением: A + B = C и имеет первый порядок по веществу А и по веществу B. При начальных концентрациях С0(A) = 3 моль/л и С0(B) = 5 моль/л скорость прямой реакции равна 0,3 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация A уменьшится на 2 моль/л. 2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 10 до 700С, если температурный коэффициент скорости gравен 2? 3. Скорость реакции A(тв) + 2B(газ) = C(тв) выражается уравнением: Вариант №4 1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Рассчитать скорость прямой реакции в тот момент, когда прореагирует 40% вещества B, если начальные концентрации равны: С0(А) = 8 моль/л; С0(B) = 4 моль/л; k = 0,4. 2. Некоторая реакция при 1000С заканчивается за 5 мин. За какое время она закончится при 800С, если температурный коэффициент скорости g равен 3? 3. Скорость реакции 3A + B = C выражается уравнением: а) при увеличении концентрации вещества A в 2 раза? б) при одновременном уменьшении концентрации исходных веществ в 2 раза? Вариант №5 1. Скорость некоторой реакции при повышении температуры с 40 до 700С увеличилась в 8 раз. Определить величину g. 2. Реакция протекает по уравнению: A + 3B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 2 моль/л; С0(B) = 6 моль/л; k = 1. Рассчитать начальную скорость прямой реакции и скорость в тот момент, когда концентрация вещества A уменьшилась на 1 моль/л. Как изменится скорость химической реакции? 3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза? Вариант №6 1. В закрытом сосуде находится смесь газов, состоящая из 1 моль A и 3 моль B, которая реагирует по уравнению: A + 3B = 2C. Скорость прямой реакции описывается уравнением 2. На сколько градусов надо увеличить температуру, чтобы скорость реакции возросла в 9 раз, если температурный коэффициент скорости g равен 3? 3. Как изменится скорость прямой газофазной реакции: 2A = B, порядок которой оценивается как 0,5, при изотермическом уменьшении давления в системе в 3 раза? Вариант №7 1. Реакция между веществами А и В протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и по веществу В. Начальные концентрации реагирующих веществ составили: С0(A) = 1,5 моль/л; С0(B) = 3 моль/л; k = 0,4. Вычислить скорость химической реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 75% А. 2. Чему равен температурный коэффициент скорости g, если при увеличении температуры на 300С скорость реакции возрастает в 27 раз? 3. Как изменятся скорости прямой и обратной реакций, протекающих в газовой фазе и подчиняющихся уравнениям:
при изотермическом увеличении давления в 2 раза?
Вариант №8 1. В растворе объемом 1 л, содержащем 1 моль вещества A и 2 моль вещества B, протекает реакция: A + 3B = 2C + D. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Во сколько раз уменьшится скорость прямой реакции после того, как прореагируют 0,65 моль вещества A? 2. При повышении температуры от -5 до +50С скорость бактериального гидролиза (ферментативный процесс) увеличивается в 4 раза. Найти значение температурного коэффициента скорости реакции g. 3. Во сколько раз следует увеличить концентрацию вещества A в системе 2A(газ) = B(газ) + C(тв.), чтобы скорость прямой реакции, которая является реакцией второго порядка, увеличилась в 4 раза? Вариант №9 1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Скорость прямой реакции равна 8 моль/л×с. Рассчитать константу скорости и скорость прямой реакции в тот момент, когда прореагирует 30% вещества B, если начальные концентрации равны: С0(A) = 2 моль/л; С0(B) = 1 моль/л. Как изменится скорость химической реакции? 2. При увеличении температуры от 10 до 500С скорость реакции увеличилась в 16 раз. Определить температурный коэффициент скорости g. 3. Реакция протекает по уравнению: A + B = C + D + E и имеет первый порядок по веществу А и нулевой по веществу B. Как изменится скорость прямой реакции после разбавления реагирующей смеси в 3 раза? Вариант №10 1. Реакция протекает по уравнению: A + 2B = AB2 и имеет первый порядок по веществу А и второй по веществу B. Константа скорости реакции равна 0,01. Рассчитать скорость реакции при начальных концентрациях: С0(A) = 0,8 моль/л; С0(B) = 0,8 моль/л и скорость реакции к моменту образования 0,2 моль/л вещества АВ2. 2. Во сколько раз увеличится скорость химической реакции при повышении температуры от 30 до 600С, если температурный коэффициент скорости g равен 3? 3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 6 часам. Определить, за какое время содержание препарата в организме человека уменьшится в 8 раз. Вариант №11 1. Реакция протекает по уравнению: A + B = 2C и имеет первый порядок по веществу А и по веществу B. Начальные концентрации веществ равны: С0(A) = 0,3 моль/л; С0(B) = 0,5 моль/л; k = 0,1. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация А уменьшится на 0,1 моль/л. 2. При 1000С некоторая реакция заканчивается за 16 минут. Принимая температурный коэффициент скорости g равным 2, рассчитать, через сколько минут закончилась бы эта же реакция при 1400С? 3. Период полувыведения препарата из организма больного (реакция первого порядка) равен 2 часам. Определить время, за которое из организма будет выведено 99% препарата. Вариант №12 1. Реакция протекает по уравнению: A + 2B = C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации веществ равны: С0(A) = 0,9 моль/л; С0(B) = 1,5 моль/л; k = 0,6. Найти начальную скорость реакции и скорость по истечении некоторого времени, когда израсходуется 50% вещества A. 2. Чему равен температурный коэффициент скорости химической реакции g, если при увеличении температуры на 300С скорость возрастает в 27 раз? 3. Период полупревращения некоторой реакции первого порядка равен 30 мин. Рассчитать, какая часть от исходного количества останется через 1 час.
Вариант №13 1. Реакция протекает по уравнению: 2A + B = 2C и имеет второй порядок по веществу А и первый по веществу B. Константа скорости реакции равна 5×10-2. Рассчитать скорость реакции при начальных концентрациях С0(A) = 0,4 моль/л; С0(B) = 0,9 моль/л и скорость реакции к моменту образования 0,1 моль вещества С. 2. При температуре 100С реакция протекает за 80 минут. При какой температуре реакция закончится за 20 минут, если температурный коэффициент скорости gравен 2? 3. В ходе лабораторных исследований было установлено, что за сутки концентрация препарата в организме больного снизилась от 0,1 моль/л до 0,02 моль/л. Вычислить период полуэлиминации препарата, считая, что данная реакция первого порядка. Вариант №14 1. В закрытом сосуде объемом 1 л находится смесь газов, состоящая из 1 моль газа A и 3 моль газа B, которая реагирует по уравнению: A + 3B = 2C. Прямая реакция имеет первый порядок по веществу А и второй по веществу B. Как изменится скорость прямой реакции после того, как прореагирует 0,5 моль газа A? 2. При увеличении температуры системы от 10 до 500С скорость химической реакции увеличилась в 16 раз. Определить температурный коэффициент скорости реакции g. 3. Во время аварии на Чернобыльской АЭС (1986 г.) произошел выброс радионуклида Cs-137, период полураспада которого составляет 30 лет. Рассчитать, какая часть попавшего в организм радионуклида осталась в настоящее время. Вариант № 15 1. Реакция протекает по уравнению: A + B = C имеет первый порядок по веществу А и по веществу B. При начальных концентрациях веществ С0(A) = 0,6 моль/л; С0(B) = 0,8 моль/л скорость реакции равна 0,03 моль/л×с. Определить константу скорости и скорость реакции через некоторое время, когда концентрация вещества A уменьшится на 0,3 моль/л. 2. Скорость реакции при 00С равна 1 моль/л×с. Вычислить скорость этой реакции при 300С, если температурный коэффициент скорости реакции равен 3. 3. Константа скорости гидролиза пестицида при 250С равна 0,32 с-1. Исходная концентрация пестицида в пробе составила 2,5 моль/л. Рассчитать, за какое время концентрация пестицида снизится до 0,01 моль/л. Вариант №16 1. Реакция разложения протекает по уравнению: 2A = 2B + C и имеет второй порядок по веществу А. Константа скорости данной реакции при 2000С равна 0,05. Начальная концентрация С(A) = 2 моль/л. Определить скорость реакции при указанной температуре в начальный момент и в тот момент, когда разложится 80% вещества A. 2. Как изменится скорость прямой реакции: 2A(тв) + 3B(газ) = 2С(тв), которая имеет нулевой порядок по веществу А и третий по веществу B, если давление в системе увеличить в 3 раза? 3. В ходе некоторой реакции первого порядка за 45 мин превращению подвергается 20% исходного количества вещества. Определить, какая часть вещества останется через 1,5 часа. Вариант №17 1. Взаимодействие газов протекает по уравнению: A + 2B = 2C и имеет первый порядок по веществу А и второй по веществу B. Начальные концентрации газов равны: С0(A) = 2 моль/л; С0(B) = 4 моль/л; k = 0,02. Вычислить скорость прямой реакции в начальный момент времени и по истечении некоторого времени, когда прореагирует 50%вещества A. 2. При 200С реакция протекает за 2 мин. За какое время будет протекать эта же реакция при 00С, если g = 2? 3. Муравьиная кислота разлагается на оксид углерода (IV) и водород на поверхности золота. Константа скорости этой реакции при 1400С равна 5,5×10-4 мин–1, а при 1850С составляет 9,2×10-3 мин–1. Определить энергию активации данной реакции.
Вариант №18 1. Реакция протекает по уравнению: 2A + B = 2C и имеет первый порядок по веществу А и по веществу B. Скорость реакции 0,5 моль/л×с. Начальные концентрации веществ равны: С(A) = 6 моль/л; С(B) = 3 моль/л. Определить константу скорости данной реакции и скорость реакции через некоторое время, когда концентрация вещества B уменьшится на 1 моль/л. 2. При 200С реакция протекает за 2 мин. За сколько времени будет протекать эта же реакция при 500С, если g = 2? 3. Константа скорости реакции инверсии тростникового сахара при 250С равна 9,67×10-3 мин-1, а при 400С составляет 73,4×10-3 мин–1. Определить энергию активации данной реакции в указанном интервале температур. БЛОК ИНФОРМАЦИИ Химическое равновесие Химические реакции бывают необратимыми и обратимыми. Необратимыми называют реакции, которые протекают только в одном направлении. В частности, к необратимым реакциям относятся те, которые сопровождаются образованием осадка, газа или малодиссоциирующего вещества (например, Н2О). Примеры: BaCl2 + K2SO4 Na2CO3 + 2HCl HCl + KOH Необратимые реакции протекают до конца, т.е до полного израсходования одного из реагентов. Выход продукта в таких реакциях близок к 100%. Практика показывает, что таких реакций не так много. Обратимыми называют реакции, которые одновременно протекают в двух противоположных направлениях. Большинство реакций являются обратимыми. Такие реакции не протекают до конца и характеризуются выходом продукта, который всегда <100%. При записи подобных реакций вместо знака равенства пользуются противоположно направленными стрелками. Примеры: N2 + 3H2 ⇄ 2NH3 H2 + I2 ⇄ 2HI 2NO + O2 ⇄ 2NO2 Следует отметить, что полностью необратимых реакций в природе не существует. Для любого химического процесса можно подобрать такие условия, при которых он станет обратимым.
|
||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 2410; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.022 с.) |

 X1
X1 B
B  C.
C.
 Br• + Br•;
Br• + Br•; O• + O•;
O• + O•;
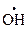 , первоначально необходимого для совершения этой группы реакций, приводит затем к образованию трех радикалов /
, первоначально необходимого для совершения этой группы реакций, приводит затем к образованию трех радикалов /  /.
/.

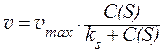 ,
,
 – максимальная скорость реакции, т. е. скорость, когда весь фермент находится в составе фермент-субстратного комплекса.
– максимальная скорость реакции, т. е. скорость, когда весь фермент находится в составе фермент-субстратного комплекса. ;
;
 ;
;








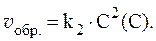
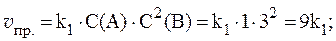






 = 700С,
= 700С, 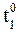 = 500С, a
= 500С, a  и
и  - скорости реакции при данных температурах.
- скорости реакции при данных температурах.

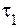 и
и  - время реакции при температурах
- время реакции при температурах 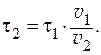

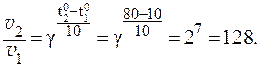

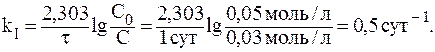



 ,
,




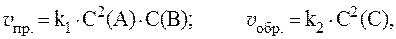
 Во сколько раз изменится скорость реакции при увеличении концентрации исходных веществ в 3 раза?
Во сколько раз изменится скорость реакции при увеличении концентрации исходных веществ в 3 раза? Как изменится скорость реакции, если концентрацию B увеличить в 2 раза?
Как изменится скорость реакции, если концентрацию B увеличить в 2 раза? Во сколько раз изменится скорость прямой реакции:
Во сколько раз изменится скорость прямой реакции:
 Во сколько раз уменьшится скорость прямой реакции после того как прореагирует 0,5 моль A?
Во сколько раз уменьшится скорость прямой реакции после того как прореагирует 0,5 моль A?



