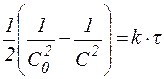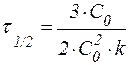Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Порядок и молекулярность реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Реакции, подчиняющиеся уравнениям типа:
принято классифицировать по признаку кинетического порядка. Общим или суммарным порядком реакции называют сумму всех показателей степеней при концентрациях в выражении закона действующих масс, установленным опытным путем: n = a + b + c …, где a, b, с - частные порядки реакции, соответственно по веществам A, B и C. Наиболее просты следующие случаи: 1) реакции нулевого порядка: 2) реакции первого порядка:
 3) реакции второго порядка: 3) реакции второго порядка:  , ,
 4) реакции третьего порядка: 4) реакции третьего порядка:  , ,
С общим кинетическим порядком выше третьего встречаться практически не приходится. Для элементарных реакций (т. е. протекающих в один элементарный акт) показатели степеней a, b и c обычно представляют собой положительные целые числа. Для более сложных реакций известны дробные и даже отрицательные показатели. Другой характеристикой механизма протекания химических реакций является молекулярность реакции. Молекулярностью реакции называется число молекул, участвующих в одном элементарном акте реакции. Следует отметить, что понятие молекулярности можно применять только для элементарных реакций. К числу элементарных реакций относится, например, разложение 1,2-диметилдиазена:
Данная реакция является мономолекулярной - в элементарном акте участвует одна молекула. Если в одном акте в реакцию вступают две молекулы, то реакция является бимолекулярной. Например:
Соответственно при тримолекулярной реакции в одном элементарном акте участвуют три частицы (молекулы):
Интересно, что большинство реакций, встречающихся на практике, кажутся простыми. Однако детальное изучение кинетики показывает, что зачастую они протекают по более сложным механизмам. Так, реакция термического разложения паров дихлорэтана:
на первый взгляд представляется элементарной.
Действительно, кинетическое уравнение этой реакции имеет вид:
что указывает на первый порядок. Однако данная реакция не является мономолекулярной, так как протекает в несколько стадий:
В этом механизме первая и третья стадии мономолекулярны, а вторая и четвертая – бимолекулярны. Очевидно, говорить о молекулярности реакции разложения дихлорэтана в целом нельзя. В то же время можно говорить о ее первом кинетическом порядке. Данный пример наглядно иллюстрирует факт, что порядок реакции далеко не всегда совпадает с ее молекулярностью. В целом, моно-, би- и тримолекулярные реакции являются, соответственно, реакциями первого, второго и третьего порядков; обратное же заключение может оказаться ошибочным. Реакции I порядка Для реакций I порядка убыль концентрации реагента определяется уравнением:
где С – концентрация вещества в данный момент времени; С0 – начальная концентрация вещества; kI – константа скорости реакции первого порядка; t – время. В логарифмической форме это выражение выглядит так:
Из приведенных формул можно сделать ряд важных заключений: 1) константа скорости реакции первого порядка имеет размерность [время-1] и может быть выражена в обратных секундах, минутах, часах и т. д.; 2) величина kI не зависит от способа выражения концентрации реагента; 3) в реакциях первого порядка одинаковым промежуткам времени отвечают одинаковые доли прореагировавшего вещества. Последнее утверждение позволяет ввести понятие период полупревращения. Периодом полупревращения (t1/2) называют время, необходимое для превращения половины первоначального количества вещества. Таким образом, в момент времени t = t1/2 количество непрореагировавшего вещества составляет
Из данной формулы следует, что в реакциях первого порядка период полупревращения не зависит от начальной концентрации реагента. В некоторых случаях удобно использовать формулу:
которая позволяет определить время, за которое превращению подвергнется определенное количество исходного вещества. В организме человека процессы метаболизма лекарственных препаратов протекают, в основном, в соответствии с уравнением реакции первого порядка. Период, за который превращению подвергается половина действующего начала препарата называется периодом полувыведения или полуэлиминации. Зная величины kI и t1/2, можно рассчитать оптимальные промежутки времени между приемами лекарственного средства. Кинетические уравнения реакций различного порядка представлены в табл. 2.
Табл. 2. Кинетические уравнения реакций различного порядка.
* при равных исходных концентрациях реагирующих веществ
Из приведенных уравнений следует, что для реакций различного порядка константы скорости имеют неодинаковые размерности. Действительно, константа скорости реакции второго порядка имеет размерность [л·моль-1·время-1)], третьего порядка - [л2·моль-2·время-1]. Таким образом, сравнивать значения констант скорости реакций различного порядка нельзя.
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 566; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.103.203 (0.006 с.) |


 , n = 0;
, n = 0; , n = 1;
, n = 1;
 ,
,
 CH3N = NCH3 C2H6 + N2.
CH3N = NCH3 C2H6 + N2. H2 + I2 2HI.
H2 + I2 2HI. 2NO + O2 2NO2
2NO + O2 2NO2 CH2Cl – CH2Cl CHCl = CH2 + HCl
CH2Cl – CH2Cl CHCl = CH2 + HCl ,
, 1) C2H4Cl2 C2H4Cl + Cl•
1) C2H4Cl2 C2H4Cl + Cl• 2) Cl• + C2H4Cl2 C2H3Cl2 + HCl
2) Cl• + C2H4Cl2 C2H3Cl2 + HCl 3) C2H3Cl2 C2H3Cl + Cl•
3) C2H3Cl2 C2H3Cl + Cl• 4) C2H4Cl + Cl• C2H4Cl2
4) C2H4Cl + Cl• C2H4Cl2

 С0. В этом случае:
С0. В этом случае: .
.
 ,
,