
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связь между различными способамиСодержание книги
Поиск на нашем сайте
Выражения концентрации растворов
Эталоны решения задач 1. Вычислить массовую долю NaCl, если 20 г NaCl растворено в 180 г Н2О.
2. Вычислить массу воды, которую необходимо добавить к 200 г раствора NaCl с w(NaCl) = 2%, чтобы получить раствор с w(NaCl) = 0,9%.
3. 500 мл раствора HNO3 с r = 1,2 г/мл с w(HNO3) = 32% разбавили 1 л Н2О. Найти массовую долю HNO3 вполученном растворе.
4. Из 10,6 г Na2CO3 приготовили 500 мл раствора. Вычислить молярную концентрацию C(Na2CO3).
5. Имеется 200 мл раствора H2SO4 с C(H2SO4) = 0,3 моль/л. Найти m(H2SO4) в растворе.
6. Приготовить 200 мл раствора NaHCO3 с C(NaHCO3) = 0,1 моль/л. Пояснение: чтобы приготовить раствор, необходимо рассчитать массу содержащегося в нем растворенного вещества.
Решение. 1) по аналогии с предыдущей задачей: m(NaHCO3) = с(NaHCO3)·M(NaHCO3)× 2) техника приготовления раствора: а) взвесить на весах 1,68 г сухого NaHCO3. б) через воронку перенести сухое вещество в мерную колбу вместимостью 200 мл. в) добавить до метки на горлышке колбы дистиллированную воду. 7. В 200 мл раствора содержится 4,9 г H2SO4. Рассчитать C(
8. Приготовить 500 мл раствора А1С13 с C(
4) приготовление раствора аналогично задаче №6.
9. Приготовить 250 мл раствора H2SO4 с C(H2SO4) = 0,1 моль/л из раствора H2SO4 с w(H2SO4) = 10%.
2) найдем массу 10% раствора H2SO4, который содержит 2,45 г кислоты:
3) найдем
4) приготовление раствора: а) отмерить мерным цилиндром 23,2 мл 10% р-ра H2SO4; б) перенести его в мерную колбу вместимостью 250 мл; в) добавить до метки дистиллированную воду. 10. Приготовить 100 мл раствора НС1 с C(
Решение. 1) для (HCl) z = 1×1 = 1, M( 2) найдем массу HCl в приготовляемом растворе: m(HCl) = c( 3) найдем массу 5% раствора HCl, который содержит 0,365 г кислоты:
4) найдем
5) приготовление раствора аналогично предыдущей задаче. 11. c(Al2(SO4)3) = 0,02 моль/л. Найти C(
12. Приготовить 250 мл раствора CuSO4 с C(
Решение.
2) найдем массу безводного CuSO4 в растворе: m(CuSO4) = C( 3) найдем массу кристаллогидрата, содержащего 2 г CuSO4: M(CuSO4·H2O) = 160 + 5·18 = 250 г/моль;
4) приготовление раствора аналогично предыдущей задаче. Вопросы для самоконтроля 1. Что такое раствор? Приведите примеры растворов, находящихся в разном агрегатном состоянии. 2. В чем заключается отличие химической теории растворов от физической? 3. Что такое количество вещества? 4. Что называют молярной массой? 5. Что такое химический эквивалент? 6. Что такое фактор эквивалентности? 7. Что называют молярной массой эквивалента? 8. Что такое массовая доля растворенного вещества? Какова ее размерность? 9. Что такое молярная концентрация? Какова ее размерность? 10. Что такое молярная концентрация эквивалента? Какова ее размерность? 11. Что такое моляльная концентрация? Какова ее размерность? 12. Что такое титр раствора? Какова его размерность? 13. Что такое мольная доля? Какова ее размерность? 9. Какими соотношениями связаны между собой выражения концентрации: а) массовая доля и молярная концентрация; б) массовая доля и молярная концентрация эквивалента; в) молярная концентрация и молярная концентрация эквивалента? Варианты задач для самостоятельного решения Вариант №1 1. Вычислить массу воды, которую надо добавить к 300 г раствора с w(NaCl) = 5%, чтобы получить раствор с w(NaCl) = 1,5%. 2. Приготовить 200 мл раствора Al2(SO4)3 с C( Вариант №2 1. К 500 г раствора NaCl с w(NaCl) = 0,05 добавили 300 г Н2О. Вычислить w(NaС1) в полученном растворе. 2. Приготовить 200 мл раствора CuSO4 с C( Вариант №3 1. В 200 мл раствора содержится 10 г H2SO4. Вычислить C(H2SO4) и C( 2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO4×5H2O в 200 г Н2О. Вариант №4 l. w(Na2CO3) = 10%, r = l,05 г/мл. Вычислить C(Na2CO3) и C( 2. Приготовить 200 мл раствора Na2CO3 с w(Na2CO3) = 0,5% (r» 1 г/мл) из кристаллогидрата Na2CO3×10H2O. Вариант №5 1. C(H2SO4) = 0,01 моль/л, r = 1 г/мл. Вычислить w(H2SO4) и C( 2. Приготовить 200 мл раствора FeSO4 с C(FeSO4) = 0,1 моль/л из кристаллогидрата FeSO4×7Н2О. Вариант №6 1. Вычислить C(Na2SO4) и C( 2. Приготовить 500 мл раствора CuSO4 с w(CuSO4) = 2% (r» 1 г/мл) из раствора с C(CuSO4) = 2 моль/л. Вариант №7 1. Приготовить 250 мл раствора NaHCO3 с C( 2. w(H2SO4) = 3,24%. Вычислить С(H2SO4) и C( Вариант №8 1. Приготовить 200 мл раствора Na2B4O7 с w(Nа2В4О7) = 3% и r = 1 г/мл из кристаллогидрата Na2B4O7×10Н2О. 2. Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл. Вариант №9 1. Приготовить 250 мл раствора H2SO4 с C( 2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 25 г CuSO4×5Н20 в 200 г Н2О. Вариант №10 1. Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) = 0,l моль/л из раствора с w(NaHCO3) = 2%. r = 1,01 г/мл. 2. Приготовить 200 мл раствора CuSO4 с C( Вариант № 11 1. Вычислить массу воды, которую надо добавить к 300 г раствора NaCl с w(NaCl) = 5%, чтобы получить раствор с w(NaCl) = 1,5%. 2. Приготовить 500 мл раствора CuSO4 с w(CuSO4) = 2% (r» 1 г/мл) из раствора с C(CuSO4) = 4 моль/л. Вариант №12 1. К 500 г раствора NaCl с w(NaCl) = 0,05 добавили 500 г Н2О. Вычислить w(NaCl) в полученном растворе. 2. Приготовить 500 мл раствора NaHCO3 с C( Вариант №13 1. В 200 мл раствора содержится 10 г H2SO4. Вычислить C(H2SO4) и с( 2. Приготовить 400 мл раствора Na2B4O7 с w(Na2B4O7) = 2% и r = 1 г/мл из кристаллогидрата Na2B4O7·10Н2О. Вариант №14 1. w(Na2CO3) = 5%, r = 1,03 г/мл. Вычислить c(Na2CO3) и с( 2. Приготовить 200 мл раствора Al2(SO4)3 с с( Вариант №15 1. C(H2SO4) = 0,01 моль/л, r = 1 г/мл. Вычислить w(H2SO4) и C( 2. Приготовить 400 мл раствора Na2CO3 с w(Na2CO3) = 1% (r» 1 г/мл) из кристаллогидрата Na2CO3×10Н2О. Вариант №16 1. Вычислить C(Na2SO4) и C( 2. w(H2SO4) = 6,24%. Вычислить C(H2SO4) и C( Вариант №17 1. Рассчитать титр раствора, полученного растворением 4 г КОН в воде в колбе вместимостью 500 мл. 2. Приготовить 500 мл раствора FeSO4 c C(FeSO4) = 0,2 моль/л из кристаллогидрата FeSO4×7Н2О. Вариант №18 1. Приготовить 100 мл раствора NaHCO3 с C(NaHCO3) = 0,05 моль/л из раствора с w(NаНСО3) = 2% и r = 1,01 г/мл. 2. Вычислить массовую долю безводного CuSO4 в растворе, полученном растворением 50 г CuSO4×5Н2О в 400 г Н2О.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 473; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.60.62 (0.01 с.) |


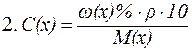
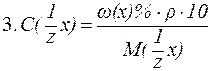
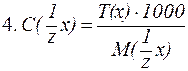



 = 200 г
w(NaCl) = 2%
w¢(NaCl) = 0,9%
= 200 г
w(NaCl) = 2%
w¢(NaCl) = 0,9%
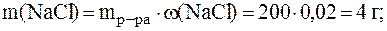
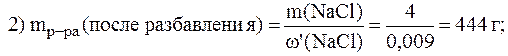

 = 500 мл
w(HNO3) = 32% = 0,32
= 500 мл
w(HNO3) = 32% = 0,32
 = 1,2 г/мл
V(Н2O) = 1л = 1000 мл
= 1,2 г/мл
V(Н2O) = 1л = 1000 мл






 H2SO4).
H2SO4). 2)
2) 

 2)
2) 

 = 1,056 г/мл.
= 1,056 г/мл. (H2SO4) -?
(H2SO4) -?
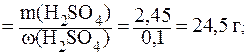

 (HCl) = 1,02 г/мл
w(HCl) = 5% = 0,05
(HCl) = 1,02 г/мл
w(HCl) = 5% = 0,05
 (HCl) -?
(HCl) -?
 , следовательно:
, следовательно:

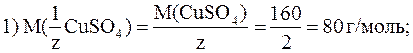
 CuSO4)·M(
CuSO4)·M( ;
;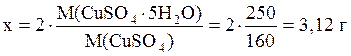 .
.


