
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Понятие о скорости химической реакцииСодержание книги
Поиск на нашем сайте
Среднюю скорость реакции
Скорость химической реакции зависит от концентрации вещества, температуры и наличия катализатора. Химические реакции могут быть гомогенными и гетерогенными. В гетерогенных реакциях и исходные, и полученные вещества находятся в одной и той же фазе; при этом исходные вещества взаимодействуют по всему объёму. Фазой называется однородная часть системы, ограниченная от других частей системы поверхностью раздела. В гетерогенных реакциях и исходные вещества, и продукты реакции находятся в разных фазах, а взаимодействие реагентовпроисходит по поверхности раздела фаз. 3.2. Зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс Гомогенные элементарные химические реакции подчиняются закону действующих масс. При постоянных температуре и объёме скорость реакции пропорциональна концентрации реагирующих веществ, возведённых в степень, равную их стехиометрическим коэффициентам. Для элементарной, гомогенной реакции a A + b B ® c C + d D. скорость выражается кинетическим уравнением где СА и СB – молярные концентрации реагирующих веществ; a и b – стехиометрические коэффициенты; k – константа скорости. Величина константы скорости зависит от природы реагирующих веществ, температуры и не зависит от концентрации реагирующих веществ. Константа скорости численно равна скорости реакции при концентрацииреагирующих веществ,равных единице. В кинетическом уравнении для газообразных веществ вместо концентрации удобнее использовать парциальные давления
Пример 1. Как изменяется скорость реакции 2NO(г) + С12(г) = 2NOCl(г), если при постоянной температуре: а) повысить концентрацию NO в 2 раза; б) повысить давление в системе в 2 раза? Решение. 1. Влияние концентрации на скорость реакции. Кинетическое уравнение дляданной реакции имеет вид:
Следовательно, скорость химической реакции возросла в 4 раза. 2. Влияние давления на скорость реакции. Исходные вещества газообразны, поэтому,используя их парциальные давления, получаем следующее кинетическое уравнение: При повышении давления в системе в 2 раза парциальное давление каждого компонента возрастает в 2 раза и становится равным 2PNO и 2 Отсюда Химические реакции по механизму протекания условно делят на простые исложные. Простые реакции, протекающие в одну стадию, называют элементарными. Реакции, протекающие в несколько стадий, называют сложными. Кроме того, реакции подразделяют по признаку молекулярности и порядку реакции. Число молекул, принимающих участие в химической реакции, определяет молекулярность реакции. Общий порядок реакции определяют как сумму показателей степеней при концентрациях в кинетическом уравнении. Пример 2. Реакция 2 NO2(г) + F2(г) = 2 NO2F(г) протекает по стадиям: 1) NO2 + NO2 = N2O4 (быстрая); 2) N2O4 + F2 = 2NO2F (медленная). Какой стадией лимитируется процесс? Напишите кинетическое уравнение скорости реакции. Определите молекулярность, общий порядок реакции и порядок реакции по веществу F2. Решение. Наиболее медленной стадией является реакция 2. Именно она определяет общую скорость всего процесса. Поэтому кинетическое уравнение можно записать в виде Согласно данному уравнению сумма показателей степеней при концентрациях реагирующих веществ равна двум. Следовательно, сложная трехмолекулярная реакция 2NO2(г) + F2(г) = 2NO2F(г) является реакцией второго порядка. Порядок реакции по веществу F2(г) равен 1, т.к. показатель степени при концентрации этого вещества (СF2) в кинетическом уравненииравен 1. Пример 3. Напишите кинетическое уравнение для гетерогенной реакции горения серы:S(к)+O2(г) =SО2(г). Решение. В рассматриваемом случаереакция происходит не во всём объёме реагирующихвеществ, а только на поверхности раздела фаз. Поэтому скорость реакциипри постоянной температуре будет зависеть не только от концентрации веществ, но и от поверхности раздела фаз, на которой происходят соударения между молекулами кислорода и серы. Но так как степень измельчения твёрдого вещества в процессе реакции не изменяется, то в кинетическое уравнение реакции входит только концентрация кислорода и оно запишется в следующем виде:
|
||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.006 с.) |

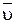 определяют как изменение концентраций (ΔС) одного из участников реакции во времени (∆τ):
определяют как изменение концентраций (ΔС) одного из участников реакции во времени (∆τ): = k СаА ∙ СbB,
= k СаА ∙ СbB, (давление, которое создают молекулыданного компонента газовой смеси).
(давление, которое создают молекулыданного компонента газовой смеси). . При повышении концентрации NО в 2 раза она станет 2CNO и кинетическое уравнение принимает вид
. При повышении концентрации NО в 2 раза она станет 2CNO и кинетическое уравнение принимает вид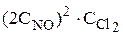 , отсюда
, отсюда  =4.
=4.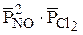 .
.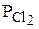 . Следовательно,
. Следовательно, 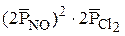 = 8k ·
= 8k ·  = 8.
= 8. .
. .
.


