
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы и эдсСодержание книги
Поиск на нашем сайте
При изучении этого раздела рекомендуется проработать следующие вопросы: понятие об электродных потенциалах; гальванические элементы (ГЭ); электродвижущая сила гальванического элемента (ЭДС) и ее измерение; стандартный водородный электрод и водородная шкала потенциалов; уравнение Нернста; потенциалы металлических, газовых и окислительно-восстановительных электродов; кинетика электродных процессов; электрохимическая и концентрационная поляризация [1,10]. Гальванический элемент – электрохимическая система, состоящая из электродов, погруженных в раствор электролитов и соединенных между собой металлическим проводником, образующим внешнюю цепь элемента. В основе работы гальванического элемента лежат процессы, происходящие на границе металлический электрод – электролит, в результате которых образуется двойной электрический слой. За счет двойного электрического слоя возникает скачок потенциала, называемого электродным. Величина электродного потенциала металла является количественной характеристикой его активности. Для того, чтобы можно было сравнивать активность различных металлов вводится понятие стандартного электродного потенциала j0. Чем более отрицательное значение имеет потенциал металла, тем более сильными восстановительными способностями обладает этот металл. И наоборот, чем более положителен потенциал металлического электрода, тем более сильными окислительными способностями обладают ионы. Величина потенциала металлического электрода зависит от температуры, активности ионов и рассчитывается по формуле Нернста
где R – универсальная газовая постоянная; Т – абсолютная температура, К; n – число электронов, участвующих в процессе; F – постоянная Фарадея, равная 96548 Кл/моль; а После подстановки значений постоянных и перевода натурального логарифма в десятичный формула Нернста приобретает вид:
Потенциалы водородного и кислородного электродов, являющиеся газовыми электродами, зависят от рН раствора и парциального давления. Потенциалы этих электродов приведены в табл.10.
Пример 1. Вычислите электродный потенциал водородного электрода в нейтральной среде при Решение. Электродный потенциал водородного электрода определяется по формуле Нернста, исходя из схемы электродного процесса: 2Н+ + 2е– «Н2 окисленная восстановленная форма форма
Поскольку активность ионов водорода в нейтральной среде а
Полученное значение Пример 2. Серебряный электрод опущен в раствор нитрата серебра AgNO3 с активностью ионов Решение. Электродный процесс: Ag+ + e– «Ag окисленная восстановленная форма форма Электродный потенциал серебра рассчитывается по уравнению Нернста:
Пример 3. Составьте схему гальванического элемента, построенного из железного и медного электродов, опущенных в растворы собственных солей. Напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС этого ГЭ, если активности ионов в соответствующих растворах следующие: Решение. Ионно-электронные уравнения электродных процессов: А: Fe – 2e– ® Fe2+ K: Cu2+ + 2e– ® Cu Железный электрод является анодом, так как его стандартный электродный потенциал ( Схема данного в условии гальванического элемента имеет вид: (–) Fe/Fe2+ // Cu2+/Сu (+) Определяем ЭДС элемента: ЭДС = j0К – j0А = Электродный потенциал анода определяем по уравнению Нернста, а потенциал катода является стандартной величиной: jА = ЭДС = 0,34 –(–0,499) = 0,839 В. Пример 4. Схема гальванического элемента имеет вид: (–) Zn/ZnCl2//ZnCl2/Zn(+). Рассчитайте ЭДС этого элемента, если в одном полученном элементе активность ионов цинка 0,001 моль/л, а в другом – 0,01 моль/л. Напишите уравнения анодного и катодного процессов. Решение: В условии задачи дан концентрационный гальванический элемент. В таком элементе катодом будет цинк, опущенный в раствор соли с более высокой активностью ионов Zn2+ = 0,01 моль/л. Уравнение электродных процессов: А: Zn – 2e– ® Zn2+ K: Zn2+ + 2e– ® Zn Определяем ЭДС элемента: ЭДС = j0К – j0А
Электродные потенциалы находим по уравнению Нернста:
jК = jА = ЭДС = j0К – j0А = – 0,819 –(–0,848) = 0,029 В.
Пример 5. Для гальванического элемента: (–) Mn/Mn2+ // 2H+/H2, Ni (+) напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов марганца 1 · 10–2 моль/л, а ионов водорода 1,0 моль/л (при
Решение. Уравнения электродных процессов: А: Mn – 2e– ® Mn2+ K: 2H+ + 2e– ® H2 (в кислой среде на катоде идет процесс водородной деполяризации) При работе гальванического элемента ЭДС и ток уменьшаются. Это связано с изменениями электродных потенциалов анода и катода. Изменение электродных потенциалов, приводящее к уменьшению ЭДС и силы тока, называется поляризацией. Различают три вида поляризации: газовую, концентрационную и электрохимическую. Разность между равновесным потенциалом электрода и его потенциалом в том же растворе при прохождении электрического тока, называется перенапряжением (табл.11 приложения). В условиях данной задачи перенапряжение выделения водорода на катоде
Электродный потенциал анода определяем по формуле
ЭДС = –0,30 – (–1,239) = 0,939 В.
Пример 6. Вычислите величину потенциала окислительно-восстановительного электрода Pt/Sn4+, Sn2+, если Решение. Потенциал окислительно-восстановительного электрода определяется по уравнению:
Тогда Пример 7. Железный электрод в растворе своей соли имеет электродный потенциал Решение. Определяем активность ионов железа, используя уравнение Нернста:
Так как – 0,47 = – 0,44 + – 0,47 = – 0,44 +
Пример 8. Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие: Zn + 2Ag+ «Zn2+ + 2Ag, если Решение. Стандартная ЭДС гальванического элемента определяется по уравнению: ЭДС = – где nF – количество электричества, которое теоретически можно получить при электрохимическом превращении одного моля вещества; F – постоянная Фарадея (F = 96,548 кДж/В · моль), или F» 96500 Кл/моль, n = 2;
т.к. стандартные энергии Гиббса образования простых веществ цинка и серебра равны нулю, тогда подставляя числовые значения величин, находим:
ЭДС = – КОНТРОЛЬНЫЕ ЗАДАНИЯ 201. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС цинко-магниевого гальванического элемента, в котором активность ионов цинка Ответ: 1,571 В. 202. Для гальванического элемента (–) Cr/Cr3+ // 2H+/H2, Fe (+) напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов хрома
Ответ: 0,419 В. 203. Алюминиевая и медная пластины соединены внешним проводником и опущены в раствор серной кислоты. Составьте схему гальванического элемента и напишите ионно-электронные уравнения электродных процессов, протекающих на аноде и на катоде. 204. Вычислите электродный потенциал водородного электрода в кислой среде при при Ответ: 9 · 10–3 В. 205. Составьте схему, напишите ионно-электронные уравнения электродных процессов, вычислите ЭДС железно-ртутного гальванического элемента, в котором активность ионов железа Ответ: 1,319 В. 206. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению: Mg + 2AgNO3 ® Mg(NO3)2 + 2Ag. Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов магния Ответ: 3,043 В. 207. Составьте схему гальванического элемента, в основе которого лежит химическая реакция, протекающая по уравнению: Zn + Pb(NO3)2 ® Zn(NO3)2 + Pb. Напишите ионно-электронное уравнение электродных процессов и вычислите ЭДС этого элемента, если активность ионов цинка Ответ: 0,659 В. 208. Вычислите величину потенциала окислительно-восстановительного электрода Pt/Fe3+, Fe2+ при активности ионов железа Ответ: 0,852 В. 209. Алюминиевый электрод в растворе соли имеет электродный потенциал Ответ: 0,095 моль/л. 210. Какой гальванический элемент называется концентрационным? Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух медных электродов, опущенных в растворы сульфата меди CuSO4 c активностью ионов меди Ответ: 0,029 В. 211. Составьте схемы двух гальванических элементов, в одном из которых цинк был бы катодом, а в другом – анодом. Напишите для каждого из этих элементов ионно-электронные уравнения реакций, протекающих на катоде и аноде. 212. При какой активности ионов Mn2+ (моль/л) потенциал марганцевого электрода будет на 0,018 В меньше его стандартного электродного потенциала? Ответ: 0,25 моль/л. 213. Потенциал медного электрода в растворе хлорида меди CuCl2 составил 97% от величины его стандартного электродного потенциала. Чему равна активность ионов Ответ: 0,46 моль/л. 214. Для гальванического элемента (–) Mg/Mg2+ // 2H+/H2, Cu (+)
напишите уравнения электродных процессов и рассчитайте реальную ЭДС с учетом перенапряжения выделения водорода, если активность ионов магния Ответ: 1,968 В. 215. Вычислите ЭДС гальванического элемента, в котором при 298К установилось равновесие: Mg + Cd2+ «Mg2+ + Cd, если активность ионов магния Ответ: 1,99 В. 216. Вычислите стандартную ЭДС гальванического элемента, в котором установилось равновесие: Fe + Cu2+ «Fe2+ + Cu, если Ответ: 0,78 В. 217. Составьте схему, напишите ионно-электронные уравнения электродных процессов и вычислите ЭДС железо-медного гальванического элемента, в котором активность ионов железа Ответ: 0,839 В 218. Вычислите ЭДС гальванического элемента, в котором при 298К установилось равновесие: Cd + Cu2+ «Cd2+ + Cu, если активность ионов магния Ответ: 0.709 В. 219. Вычислите ЭДС гальванического элемента, в котором при 298 К установилось равновесие: 2Na + H2O(г) + 1/2O2 «2NaOH(к), если Ответ: 2,76 В. 220. Вычислите величину потенциала окислительно-восстановительного электрода Pt/Co3+, Co2+ при активности ионов кобальта Ответ: 1,977 В.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
При изучении этого раздела повторите теоретический материал по теме «Гальванические элементы» и приработайте следующие вопросы: определение и классификация коррозионных процессов; химическая коррозия; электрохимическая коррозия; защита металлов от коррозии [1, 10]. Пример 1. Показать какие из ниже перечисленных металлов: а) Zn; б) Fe; в) Hg; г) Cd; д)Ag – способны подвергаться коррозии в соляной кислоте. Решение. Коррозия должна протекать по электрохимическому механизму, т.к. соляная кислота проводит электрический ток. Данная кислота за счет Н+–ионов выступает в роли окислителя. Определяем возможность коррозии, сравнивая электродные потенциалы всех перечисленных выше металлов (из табл. 9) с электродным потенциалом окислителя. При рН = 0 (кислая среда) и давлении водорода равным 1 атм. Следовательно, коррозии будут подвергаться все металлы, у которых В качестве примере рассмотрим, какие процессы будут протекать при коррозии цинка в соляной кислоте. Процесс окисления (на анодных участках): А: Zn – 2е = Zn2+. К: 2Н+ + 2е = Н2. Анодные и катодные участки располагаются на поверхности цинка. Скорость анодного процесса связана со скоростью катодного. Так как скорость катодного процесса мала, о чем говорит большая величина перенапряжения выделения водорода на цинке (
Пример 2. В чем сущность протекторной защиты металлов от коррозии? Какие металлы: Zn, Cr, Sn, Cu можно использовать в качестве протектора при защите от коррозии детали из железа во влажной атмосфере?
Решение. Сущность протекторной защиты металлов от коррозии заключается в том, что защищаемый металл соединяют с другим металлом, имеющим более отрицательный электродный потенциал. В этом случае более активный металл является анодом и подвергается окислению, а защищаемый металл является катодом и не окисляется. Из табл. 9 приложения находим значения j0Zn2+/Zn = – 0,76 В; j0Cr3+/Cr = – 0,74 В; j0Fe2+/Fe = –0,44 В; j0Sn2+/Sn = – 0,14 В; j0Cu2+/Cu = 0,34 В. Следовательно, цинк и хром можно использовать для протекторной защиты изделия из железа: j0Zn2+/Zn < j0Cr3+/Cr < j0Fe2+/Fe < j0Sn2+/Sn < j0Cu2+/Cu.
Пример 3. Какие металлы можно использовать в качестве анодного и катодного покрытий для изделия из меди? Какое покрытие называется анодным, а какое – катодным? Решение. Покрытие называется анодным, если величина электродного потенциала металла более отрицательна по отношению к потенциалу защищаемого металла. Металл, применяемый в качестве катодного покрытия, имеет более положительную величину электродного потенциала по отношению к потенциалу защищаемого металла. Анодные покрытия для меди: Al, Zn, Cr, Cd. Катодные покрытия для меди: Ag, Pd, Pt. Пример 4. Показать какие процессы протекают при коррозии цинка в контакте с железом в соляной кислоте. Условия те же, что и в примере 1.
Решение. На поверхности раздела металл-раствор имеются участки металлического цинка и металлического железа. Определим, какой металл легче окисляется. С термодинамической точки зрения цинк легче окисляется, чем железо, что показывает сравнение их электродных потенциалов: j0Fe2+/Fe = –0,44 В, j0Zn2+/Zn = –0,76 В (табл. 9). Поэтому процесс окисления (анодный процесс) локализуется на поверхности цинка: А: Zn – 2е = Zn2+, что приводит к его разрушению. Наиболее сильный окислитель – ион Н+ из раствора. Сравнивая электродные потенциалы окислителя и восстановителя видим, что К: 2Н+ + 2е = Н2. Определим, где располагаются катодные участки. Процесс выделения водорода локализуется там, где он протекает с наибольшей скоростью, т.е. где наименьшее перенапряжение водорода. Сравним hН2 на железе и на цинке: Пример 5. Стальное изделие (основа железо) покрыто оловом. Какой из металлов будет подвергаться коррозии: а) в кислой среде на воздухе; б) во влажном воздухе при нарушении покрытия? Составьте схемы коррозионных гальванических элементов и напишите электронные уравнения электродных процессов. Решение. Из табл. 9 находим стандартные электродные потенциалы: j0Fe2+/Fe = –0,44 В < j0Sn2+/Sn = –0,14 В. Следовательно, при нарушении покрытия как в кислой среде, так и во влажном воздухе будет корродировать железо. Проверим это соответствующим расчетом. а. Кислая среда. Электродные потенциалы анодного и катодного процесса оценим, исходя из условий задачи, активность ионов металлов в растворах электролитов примем а Меn+ < 10-6 моль/л, а перенапряжение выделения водорода на данных электродах в кислой среде соответственно равны jFe2+/Fe = –0,44 + На Ме0: φ2H+/Н
На Fe: jК1 = На Sn: jК2 = Термодинамически более вероятна локализация катодного процесса на поверхности Fe, т.к. Электронные уравнения электродных процессов: А(Fe): Fe – 2е = Fe2+ К(Fe): 2Н+ + 2е = Н2 (катодная деполяризация) б. Влажный воздух (атмосферная коррозия) Катодный процесс описывается уравнением: О2 + Н2О + 4е = 4ОН– (кислородная деполяризация). В предложенных условиях процесс с кислородной деполяризацией будет локализован на Sn. В этом случае возникнет гальванический элемент: (–) Fe/О2, Н2О/Sn (+). Электронные уравнения электродных процессов: А(Fe): Fe – 2е = Fe2+ К(Sn): О2 + Н2О + 4е = 4ОН–.
КОНТРОЛЬНЫЕ ЗАДАНИЯ 221. Стальное изделие (основа – железо) покрыто цинком. Какой из металлов будет окисляться при коррозии в кислой среде и влажном воздухе при нарушении покрытия? Напишите электронные уравнения на аноде и катоде. 222. Изделия из луженого и оцинкованного железа эксплуатируются в атмосфере влажного воздуха. Составьте схемы коррозионных микрогальванических элементов и напишите электронные уравнения электродных процессов при нарушении покрытий. 223. Алюминиевая пластинка опущена в разбавленный раствор серной кислоты. Начавшееся выделение водорода быстро прекращается. Если к алюминиевой пластинке в растворе кислоты прикоснуться серебряной пластинкой, то на последней начнется бурное выделение водорода. Поясните этот процесс, составьте электронные уравнения реакций, протекающих на аноде и катоде. 224. Какие металлы: Fe, Ag, Pd, At можно использовать в качестве протектора при защите от коррозии детали из меди (Cu) эксплуатируемой в морской воде? В чем сущность протекторной защиты металлов от коррозии? 225. Напишите уравнения катодного процесса, протекающего при коррозии изделия из бронзы (Cu + Sn + Pb) во влажном воздухе. Составьте схему коррозионного гальванического элемента. 226. Укажите ряд металлов, которые можно использовать в качестве катодного и анодного покрытий для изделия из железа. Какое покрытие называется анодным, а какое – катодным? 227. В раствор хлороводородной (соляной) кислоты опустили железную пластинку, частично покрытую никелем. В каком случае процесс коррозии железа протекает интенсивнее? Составьте схемы коррозионных гальванических элементов и напишите электронные уравнения электродных процессов. 228. Две железные пластинки, частично покрытые одна цинком, другая серебром, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Напишите электронные уравнения анодного и катодного процессов коррозии пластинок. Укажите продукты коррозии. 229. Напишите электронные уравнения процесса коррозии луженого железа (Fe / Sn) в нейтральной водной среде при свободном доступе воздуха. Целостность покрытия нарушена. 230. Стальное изделие (основа – железо) покрыли оловом. Какое это покрытие – анодное или катодное? Напишите электронные уравнения электродных процессов коррозии при нарушении покрытия во влажном воздухе и кислой среде (соляная кислота). Укажите продукты коррозии. 231. Как протекает атмосферная коррозия стального изделия (основа – железо), покрытого слоем кадмия в случае нарушения покрытия? Напишите электронные уравнения электродных процессов. Укажите продукты коррозии. 232. Лопатки паровых турбин изготовлены из конструкционной стали (основа – железо), содержащей марганец, олово, медь, эксплуатируются во влажной атмосфере. Используя значения стандартных электродных потенциалов, определите, какая составляющая стали будет корродировать в первую очередь. Напишите электронные уравнения электродных процессов. 233. Резьбовое крепежное изделие из инструментальной стали (основа – железо), содержащей кобальт и медь, покрыто цинком. Напишите электронные уравнения анодного и катодного процессов коррозии во влажном воздухе. К какому типу (анодному или катодному) относительно основного металла относится это покрытие? 234. Изделие из сплава железа с хромом, легированного марганцем, эксплуатируется в кислой среде. Какая составляющая сплава будет корродировать в первую очередь? Напишите электронные уравнения процессов на аноде и катоде. 235. Какой из процессов: 1) Fe3+ + 1е = Fe2+; 2) 2Н+ + 2е = Н2; 3) О2 + Н2О + 4е = 4ОН–; 4) Fe2+ + 2е = Fe; протекает на катодных участках при коррозии железных изделий в атмосферных условиях? 236. Стальной сосуд (основа железо) покрытый серебром имеет глубокие царапины. Напишите электронные уравнения процессов на аноде и катоде при коррозии сосуда в растворе соляной кислоты. Какой металл растворяется при коррозии? Какое это покрытие анодное или катодное? 237. Какие из частиц: Al3+; O2; H+; Cu будут принимать электроны при коррозии алюминиевых деталей с медными включениями в кислой среде? Составьте схему коррозионного гальванического элемента и напишите электронные процессы на аноде и катоде. 238. Корпус водяного насоса из сплава марки АЛ 19 (основа – алюминий), содержащего титан, цинк и марганец, эксплуатируется во влажной атмосфере. Какая составляющая сплава будет корродировать в первую очередь? Напишите электронные уравнения электродных процессов. 239. На стальное изделие (основа – железо) нанесено многослойное покрытие (Ni, Cu, Ag). Целостность покрытия нарушена. Какой из металлов будет корродировать в первую очередь? 240. В контакте с какими из ниже приведенных металлов никель будет корродировать: Zn, Fe, Cu, Ag? ЭЛЕКТРОЛИЗ Дня решения задач, посвященных электролизу, необходимо иметь ясное представление об окислительно-восстановительных реакциях, электродах и электродных потенциалах, об электродных процессах окисления и восстановления, поляризационных явлениях на электродах, уметь рассчитывать величину электродных потенциалов по условиям электрохимического процесса с учетом поправок на электрохимическое перенапряжение [1...5, 10]. Электролиз – это окислительно-восстановительный процесс, протекающий на электродах при пропускании электрического тока через раствор или расплав электролита. При этом в раствор помещают как минимум два электрода. Один из них подсоединен к положительному полюсу источника тока и служит анодом, а другой — к отрицательному и служит катодом, на поверхности которого происходит восстановление. Для того, чтобы ток непрерывно протекал в цепи на границе раздела металл – электролит, должны протекать электрохимические процессы: прием электронов на катоде и отдача электронов на аноде. Пример 1. Какие процессы происходят на графитовых электродах при электролизе расплава СаС12? Рассчитайте величину Uт (теоретическое напряжение разложения), необходимое для проведения электролиза. Электроды графитовые Решение. Большое влияние на протекание процессов электролиза оказывает природа электродов и, прежде всего, анодов. Различают нерастворимые и растворимые аноды. Рассмотрение электрохимических процессов электролиза следует начинать с процессов окисления на аноде, т.к. возможно его растворение (окисление) и переход ионов в катодное пространство и восстановление их на катоде. Нерастворимые (инертные) аноды изготавливают из угля, графита, Pt, Аu. При электролизе нерастворимые электроды не посылают электронов во внешнюю цепь, электроны посылаются в результате окисления анионов или молекул воды при электролизе водных растворов электролитов. При рассмотрении процессов электролиза введем условные обозначения: вертикальной чертой разделим анодное и катодное пространства, электроды обозначим стрелками с указанием рядом материала, из которого они изготовлены. Возможные электродные процессы, которые мы сравниваем, подчеркнем горизонтальной чертой, а процесс, который преимущественно имеет место на аноде и катоде, заключим в рамку. Расплавы щелочей и солей хорошо диссоциируют на ионы при высоких температурах. Схема электролиза:
А(+) (–)К CaCl2 = Ca2+ + Cl–
Так как электролиз – несамопроизвольный процесс, то ΔGт > 0. ΔGт этого процесса определяется по формуле ΔGт = n∙F∙Uт. (1) где Uт – теоретическое напряжение (напряжение разложения), необходимое для проведения процесса электролиза Uт = где число n – число электронов, участвующих в процессе окисления. Используя формулу (1), находим UТ (n=2) Uт =
Пример 2. Какие возможные процессы могут иметь место на платиновых (инертных) электродах при прохождении электрического тока через дистиллированную воду? Решение. Вода является слабым электролитом, поэтому в окислительно-восстановительных процессах на электродах участвуют в основном молекулы воды по схеме:

В результате электролиза воды среда около катода становится щелочной (рН > 7), а около анода — кислой (рН < 7). Процесс электролиза выразится уравнением: 2Н2О = Н2 + О2. Пример 3. Составьте схему и напишите уравнения электродных процессов, протекающих на гладких платиновых электродах (с учетом перенапряжения) при электролизе водного раствора хлорида калия в стандартных условиях, при активности ионов a К+= 1 моль/л, среда кислая (рН < 7) за счет добавления кислоты с целью уменьшения сопротивления раствора, температура 298К, плотность тока i =10A/м2. Решение. При электролизе водных растворов электролитов происходит «конкуренция» между растворенным веществом и растворителем – водой за участие в электрохимическом процессе на электродах. Поэтому состав продуктов окисления на аноде и восстановления на катоде зависит от природы электролита и других факторов. О том, какие частицы (ионы вещества или молекулы воды) будутв первую очередь разряжаться на электродах, можно судить по величине их электродных потенциалов. Из нескольких возможных процессов будет протекать тот, осуществление которого сопряжено с минимальной затратой энергии. В соответствии с этим действует правило: на аноде в первую очередь будут окисляться восстановленные формы систем с наименьшей алгебраической величиной электродного потенциала φ (наиболее активный восстановитель), а на катоде восстанавлива
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 1306; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.16.135.146 (0.015 с.) |

 а
а  ,
, – стандартный электродный потенциал, измеренный относительно водородного потенциала при стандартных условиях (Т = 298К; а
– стандартный электродный потенциал, измеренный относительно водородного потенциала при стандартных условиях (Т = 298К; а  а
а  = 1 атм.
= 1 атм. .
. = 10–7 и
= 10–7 и  = 0, то
= 0, то В.
В. сравните с табличным (табл.10 приложения).
сравните с табличным (табл.10 приложения). = 1 · 10–2 моль/л. Вычислите электродный потенциал.
= 1 · 10–2 моль/л. Вычислите электродный потенциал.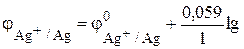 а
а  = 0,8 + 0,059 · (–2) = 0,682 В.
= 0,8 + 0,059 · (–2) = 0,682 В. = 1 · 10–2 моль/л, а
= 1 · 10–2 моль/л, а  = 1,0 моль/л.
= 1,0 моль/л. = – 0,44 В) меньше, чем подобный потенциал меди (
= – 0,44 В) меньше, чем подобный потенциал меди ( = + 0,34 В) (табл.9 приложения).
= + 0,34 В) (табл.9 приложения). а
а  = –0,44 +
= –0,44 +  = –0,44 +
= –0,44 +  = –0,499 В.
= –0,499 В. = –0,76 +
= –0,76 +  = –0,76 +
= –0,76 +  = –0,76 + +
= –0,76 + +  = –0,848 В.
= –0,848 В. = 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю:
= 0,30 В (табл. 11 приложения), а электродный потенциал водородного электрода в кислой среде при давлении водорода 1 атм принят равным нулю:  = 0 – 0,30 В = –0,30 В.
= 0 – 0,30 В = –0,30 В.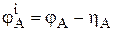 . Так как перенапряжение металла на металле условно принято равным нулю, то
. Так как перенапряжение металла на металле условно принято равным нулю, то  .
. =
=  = –1,18 +
= –1,18 +  = 0,15 В и реакция Sn4+ + 2e– ® Sn2+ протекает при активностях ионов:
= 0,15 В и реакция Sn4+ + 2e– ® Sn2+ протекает при активностях ионов:  = 0,1 моль/л, а
= 0,1 моль/л, а  = 0,001 моль/л.
= 0,001 моль/л. .
. В.
В. = –0,47 В. Вычислите активность ионов в растворе, моль/л.
= –0,47 В. Вычислите активность ионов в растворе, моль/л. ;
; ;
; = –
= –  ;
;  = – 146,5 кДж/моль, а
= – 146,5 кДж/моль, а  = 77,2 кДж/моль.
= 77,2 кДж/моль. ,
, – стандартная энергия Гиббса данной реакции равна:
– стандартная энергия Гиббса данной реакции равна: В.
В. = 1 · 10–1 моль/л, а ионов магния
= 1 · 10–1 моль/л, а ионов магния  = 1,0 моль/л.
= 1,0 моль/л. = 1 · 10–2 моль/л, а ионов водорода
= 1 · 10–2 моль/л, а ионов водорода  = 1,0 моль/л (при
= 1,0 моль/л (при  = 1 · 10–2 моль/л.
= 1 · 10–2 моль/л. = 0,01 моль/л.
= 0,01 моль/л. = 0,001 моль/л и
= 0,001 моль/л и  = 0,77 В.
= 0,77 В. = – 1,68 В. Вычислите активность ионов Al3+, моль/л.
= – 1,68 В. Вычислите активность ионов Al3+, моль/л. = 0,1 моль/л. Напишите уравнения электродных процессов.
= 0,1 моль/л. Напишите уравнения электродных процессов. = + 66,2 кДж/моль, а
= + 66,2 кДж/моль, а  = – 84,8 кДж/моль.
= – 84,8 кДж/моль. = – 228,76 кДж/моль, а
= – 228,76 кДж/моль, а  = – 380,46 кДж/моль.
= – 380,46 кДж/моль. = 1 моль/л и
= 1 моль/л и  = 0,001 моль/л, если
= 0,001 моль/л, если  = 1,8 В.
= 1,8 В. = 0 (см. табл. 10).
= 0 (см. табл. 10). = 0,83 В), то чистый цинк растворяется в кислоте медленно.
= 0,83 В), то чистый цинк растворяется в кислоте медленно. = 0,36 В,
= 0,36 В,  = 0,63 В (табл. 11 приложения).
= 0,63 В (табл. 11 приложения). lg10-6 = –0,44 – 0,177 = –0,617 В.
lg10-6 = –0,44 – 0,177 = –0,617 В. ,Ме = φ 0 2H+/H
,Ме = φ 0 2H+/H  (Ме) = 0,186 –
(Ме) = 0,186 –  = 0,186 –
= 0,186 –  = 435,7∙103 Дж/моль при Т = 1050 К.
= 435,7∙103 Дж/моль при Т = 1050 К.




 . (2)
. (2) .
.





