
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы химической связи и квантово-механическое объяснение ковалентной связи. Строение молекулСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
6.2.1. Определение типа химической связи по разности электроотрицательностей атомов, образующих связь Образование различных типов химической связи зависит от способности атомов отдавать или притягивать электроны. Такая способность характеризуется величиной электроотрицательности (ЭО). Чем больше величина ЭО. тем больше способность атомов притягивать электроны. Если разность ЭО (Δ ЭО) между двумя атомами, образующими связь равна нулю (Δ ЭО = 0), то такая связь неполярная ковалентная. При 0 < Δ ЭО < 2 связь полярная ковалентная. Ионная связь образуется при Δ ЭО > 2. Пример 3. Определите, какой тип связи а соединениях КС1, Н2, SO2. Решение: Пользуясь величинами ЭО для каждого атома (приложение, табл. П4), находим Δ ЭО.
На основании полученных данных Δ ЭО делаем вывод, что связь К–С1 ионная (ΔЭО > 2), связь Н–Н неполярная ковалентная (Δ ЭО = 0) и связь S–O полярная ковалентная (0 < ΔЭО < 2).
Пример 4: Определите, в каких молекулах (CCl4, NaH, H2S) полярность наибольшая. Решение: Находим значение ЭО для каждого атома (приложение, табл. П4) и определяем ΔЭО для каждой пары атомов, образующих химическую связь в молекулах.
Наиболее полярной является связь Na–H, так как в этом случае величина ΔЭО – самая наибольшая. 6.2.2. Нахождение электрического момента диполя связи и молекулы Дня оценки полярности связи и молекулы используют электрический момент диполя μ, равный произведению длины диполя на электрический заряд q (q = 1,602 · 10-19 Кл), т.е. μ = 1q. Для полярных связей и молекул μ > 0, для неполярных μ = 0. Электрический момент диполя – система двух равных и противоположных по знаку электрических зарядов – есть векторная величина, направленная от положительного к отрицательному заряду. Единица измерения μ – Дебай (D): D=3,33 · 10-30 Kл · м. Электрический момент диполя двухатомной молекулы равен электрическому моменту диполя связи. Электрический момент диполя многоатомной молекулы равен векторной сумме электрических моментов диполей всех связей.
Пример 5. Определите электрический момент диполя молекулы HF и его направление, если μ связи равен 1,9D (приложение, табл. П5). Решение: Молекула HF – двухатомная, имеет линейное строение: H–F. Следовательно, электрический момент диполя связи равен электрическому моменту диполя молекулы (1,91D) и направлен от водорода, имеющего положительный заряд, к отрицательному фтору: H®F (ЭОН = 2,1; ЭОF = 4,0).
Пример 6. Молекула BeН2 имеет линейное строение. Валентный угол Н–Ве–Н составляет 180°. Связи Ве–Н полярны (ЭОВе = 1,5; ЭОH = 2,1). Молекула Н2О имеет угловое строение (валентный угол Н-О-Н равен 104°30'). Связи Н–О полярны (ЭОH = 2,1; ЭОO = 3,5). Будут ли обе молекулы полярные?
Решение: В молекуле ВеН2 связи полярные и вектор электрического момента диполя связи Ве–Н2 направлен от (+) к (–), т.е. от бериллия с меньшей величиной ЭО к водороду с большей величиной ЭО, а именно H В молекуле Н2О полярные связи Н–О располагаются под углом 104°30' (рис. 1). Поэтому их электрические моменты диполей связей взаимно не

Рис. 1. Электрический момент диполя молекулы Н2О Решение: Электрический заряд q = 1,602 · 10–19 Кл. Электрический момент диполя молекулы находим по формуле μ = 1 · q = 1,602 · 10–19 · 3,37 · 10–11 = = 5,4 · 10 -30 Кл · м. (1,63 D). Ответ: 5,4 · 10–30 Кл·м. = (1,63 D).
6.2.3. Объяснение строения молекул по методу валентных связей (ВС) Образование молекул по методу ВС может происходить по обменному донорно-акцепторному механизму. Первый основан на перекрывании одноэлектронных атомных орбиталей; второй связан с наличием атомов-доноров, имеющих электронную пару, и атомов-акцепторов, у которых есть свободные орбитали. Пример 8. Объясните образование химических связей в молекуле NН3 и ее строение по обменному механизму. Решение: объяснения образования химических связей в молекуле NH3 по обменному механизму необходимо: написать электронные формулы атомов азота и водорода; определить их валентные электроны и ковалентность каждого атома. Азот 7N 1s22s22р3 – р-элемент; валентные электроны 2s2 2р3. Ковалентность атома равна трем Водород 1Н 1s1 – s-элемент; валентные электроны 1s1; ковалентность равна 1 В образовании трёх химических связей N–H в молекуле NН3 принимают участие три одноэлектронные р-орбитали атома азота и одна одноэлектронная s-орбитали трёх атомов водорода. Перекрывание s-p орбиталей происходит в направлении наибольшей вытянутости р-орбиталей в пространстве, расположенных под углом 90°. После перекрывания форма молекулы NH3 – тригональная пирамида с валентным углом H–N–H, равным 107°20' (рис. 2).
Рис. 2. Строение молекулы аммиака
Отклонение величины угла от 90° вызвано тем, что связь N–H полярна (ЭОN = 3,0; ЭОН = 2,1). Связующие электронные пары несколько смещены от атомов водорода к атому азота (ЭОN > ЭОH). Поэтому положительно заряженные атомы водорода, а также электронные пары трёх связей N–H отталкиваются друг от друга, что приводит к увеличению валентного угла до 107°20'. Пример 9. Объясните образование иона аммония NH4+ из молекулы аммиака NH3 и иона водорода Н+ по донорно-акцепторному механизму. Решение. Образование связей в молекуле NН3 по обменному механизму дано в примере 8. Как следует из объяснений, три ковалентные связи образуются по обменному механизму за счёт трех валентных одноэлектронных р-орбиталей атома азота. Но, кроме того, атом азота имеет ещё валентную двухэлектронную s-орбиталь (2s2), которая может быть донором по отношению к акцептору – иону водорода, имеющему свободную орбиталь. Поэтому атом азота может образовывать четвёртую ковалентную связь по донорно-акцепторному механизму. Образование четвёртой ковалентной связи (донорно-акцепторной) в ионе аммония NH4+ можно представить схемой:
Донор Акцептор Ион аммония имеет форму тетраэдра за счёт s1р3-гибридизации (см. п. 6.2.4).
6.2.4. Определение типа гибридизации атомных орбиталей пространственной конфигурации молекулы по методу ВС Пример 10. Определите тип гибридизации атомных орбиталей, пространственную конфигурацию и полярность молекулы ВН3. Решение. Бор 5В ls22s22p1 – р-элемент; валентные электроны 2s22p1; ковалентность атома в нормальном (невозбуждённом) состоянии равна единице Водород 1Н 1s1 – s-элемент; валентные электроны 1s1; ковалентность равна единице ковалентность равна трём. Это возможно при переводе атома из нормального в возбуждённое состояние (рис. 3).
Рис. 3. Образование гибридных орбиталей атома бора
Три гибридные орбитали располагаются симметрично в пространстве под углом 1200 друг к другу и направлены к вершинам правильного треугольника. Три гибридные орбитали атома бора образуют с одноэлектронными s-орбиталями трёх атомов водорода три химические связи в молекуле ВН3, которая имеет форму правильного треугольника (рис. 4).
Рис. 4. Строение молекулы ВН3 Несмотря на то, что связи В–Н полярны (ЭОB = 2,0; ЭОН = 2,1), молекула неполярна, т.к. имеет симметричное строение. Результирующая векторной суммы электрических моментов диполей трех связей В–Н равна нулю (см. рис. 4). Гибридизация атомных орбиталей определяет пространственную конфигурацию молекул и ионов (табл. 2). Таблица 2 Пространственные структуры некоторых молекул и ионов
6.2.5. Объяснение образования и свойств двухатомных молекул типа В2 по методу молекулярных орбиталей (МО) Согласно методу МО в молекуле нет атомных орбиталей (АО), а есть связывающие и разрыхляющие МО, полученные линейной комбинацией (смешиванием) АО. При комбинации nАС образуется nМО, из них число связывающих равно числу энергии АО. Энергия связывающих МО меньше энергии АО, а энергия разрыхляющих МО больше энергии АО. Порядок размещения электронов на МО тот же, что и в случае АО; прежде всего заполняются МО с низкой энергией (принцип минимальной энергии) в соответствии с принципом Паули и правилом Гунда. Наиболее простой случай образования МО имеет место при комбинации АО двух атомов одного и того же элемента (В2). При комбинации двух s-s AО образуются две МО, называемые σ (сигма) орбиталями. Одна из них связывающая ( Образование МО из атомных и изменение их энергии можно представить в виде энергетической диаграммы, где по вертикали откладываются значения энергии орбиталей (рис. 5).
Рис. 5. Энергетическая схема образования МО при комбинации АО двух атомов одного и того же элемента (В2) Метод МО позволяет определить магнетизм молекулы. Так, наличие непарных электронов в молекуле обусловливает её парамагнетизм, а отсутствие таковых – диамагнетизм. По методу МО можно найти кратность связи. Кратность w равна полуразности числа электронов на связывающих nсв и разрыхляющих nраз МО:
Если число электронов на связывающих и разрыхляющих МО равное, то кратность связи равна нулю. Следовательно, эти электроны не оказывают влияния на образование химической связи. По методу МО также можно объяснить устойчивость молекулы. Устойчивость молекулы связана с энергетическим балансом всех связывающих и разрыхляющих электронов. Ориентировочно можно считать, что один разрыхляющий электрон сводит на нет действие одного связывающего электрона. Таким образом, чем больше электронов на связывающих и меньше их на разрыхляющих МО, тем устойчивее молекула. Пример 11. Объясните по методу МО образование молекулы О2. Определите кратность связи и ее магнетизм. Решение. Молекула О2 состоит из атома одного и того же элемента – кислорода. Его электронная формула следующая: 8О 1s22s22p4. Валентные электроны атома кислорода 2s22p4 принимают участие в образовании химической связи, т.е. МО получаются линейной комбинацией 2s- и 2р- АО двух атомов кислорода. Согласно вышеизложенному по методу МО энергетическая диаграмма молекулы кислорода будет иметь следующий вид (рис. 6).
Рис. 6. Энергетическая диаграмма молекулы О2 Распределение двенадцати валентных электронов в молекуле кислорода происходит в соответствии с принципом минимальной энергии. Сначала заполняются
Рис. 7. Схема заполнения валентными электронами орбиталей молекулы О2
Кратность связи, рассчитанная по формуле (2), равна двум. Наличие двух непарных электронов определяет парагнетизм молекулы. КОНТРОЛЬНЫЕ ЗАДАНИЯ 101. В молекуле этина (ацетилена) С2Н2 между атомами углерода имеется тройная связь: одна s и две p связи. Образование двух p связей происходит за счет перекрывания ру-ру и двух рz-pz атомных орбиталей. Каким образом возникает s связь? Определите тип гибридизации при образовании s связи. Нарисуйте строение молекулы этина и рассчитайте энергию связи, используя данные табл. 3. Ответ: ΔН = – 245 кДж/моль. 102. Используя энергетическую диаграмму, полученную методом МО, объясните, почему молекула 103. Объясните образование химических связей в молекуле Н2О по методу ВС. Изобразите пространственную конфигурацию молекулы. Вычислите длину связи Н–О, используя данные табл.2. Ответ: 0,97 · 10–10м. 104. Объясните строение молекулы СН4 по методу ВС. Определите тип гибридизации при образовании химических связей. Используя данные табл.4, докажите, что связи в молекуле ковалентно-полярные. Почему электрический момент диполя молекулы равен нулю? 105. По методу МО постройте энергетическую диаграмму молекулы В2. Определите кратность связи и магнитные свойства молекулы. 106. По методу МО постройте энергетическую диаграмму молекулы Энергия диссоциации молекулы 107. Образование иона Объясните образование всех химических связей по методу ВС и их механизм в ионе 108. Объясните строение молекулы СCl4 по методу ВС. Определите тип гибридизации при образовании химических связей. Вычислите длину связи C–Cl в этой молекуле, используя данные табл. 2. Ответ: 1,765 · 10–10 м.
109. Объясните строение молекулы СО2 по методу ВС. Изобразите пространственную конфигурацию молекулы. Определите тип гибридизации при образовании химических связей. Используя данные табл. 4, докажите, что связи ковалентные полярные. Почему молекула СО2 имеет нулевой электрический момент диполя?
110. Молекула BF3 имеет плоскостную треугольную конфигурацию, а NF3 – объемную (пирамидальную). Используя метод ВС, объясните, в чем причина различия в строении этих молекул? Какая молекула неполярна и почему? Результат подтвердите величинами электрических моментов диполей молекул (см. табл. 5). 111. Молекула СН4 и ион 112. По методу валентных связей объясните строение молекулы этана С2Н6 (Н3С–СН3). Каков тип гибридизации химической связи? Вычислите энергию связи С–С, если стандартная энтальпия образования С2Н6 из газообразных углерода и водорода равна – 2798,8 кДж/моль, а энергия связи С–Н равна –411,3 кДж/моль. Ответ: ΔН = – 331,0 кДж/моль. 113. Используя метод ВС, объясните, почему молекулы Н2О и Н2S имеют угловое строение, при этом валентный угол <(H–O–H) = 104030¢ больше валентного угла <(H–S–H) = 920. На основании данных табл.5 вычислите длины диполей молекул и покажите направления электрических моментов диполей связей в них. Ответ: 3,83 · 10–11 и 1,55 · 10–11 м. 114. Используя метод ВС, объясните строение молекулы PCl3 и AlCl3. Какова разница геометрических конфигураций молекул? Почему молекула PCl3 полярна, а AlCl3 имеет электрический момент диполя равный нулю? 115. Используя метод ВС, объясните строение молекулы CS2. Определите тип гибридизации. Какую геометрическую конфигурацию имеет молекула? Почему электрический момент диполя равнен нулю? 116. Используя значения ЭО (приложение, табл. П4), определите тип связи в молекулах NCl3, CsF, ICl5, NF3, OF2, O2? Укажите направление смещения электронных пар в этих молекулах. Объясните строение молекулы NCl3 по методу ВС. 117. Используя метод МО, постройте энергетическую диаграмму для молекулы 118. Рассчитайте длину связи С–Н в молекуле СН4 и связи Н–S в молекуле H2S, используя данные табл. 2. Объясните строение молекулы H2S по методу ВС. Ответ: 1,14 · 10–10, 1,33 · 10–10 м. 119. По методу МО постройте энергетические диаграммы для 120. По методу МО постройте энергетические диаграммы для
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 735; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.47.194 (0.009 с.) |

 . Векторная сумма электрических моментов диполей связей, одинаковых по величине и противоположных по знаку, равна нулю. Следовательно, молекула неполярна (
. Векторная сумма электрических моментов диполей связей, одинаковых по величине и противоположных по знаку, равна нулю. Следовательно, молекула неполярна (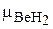 = 0).
= 0).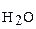 > 0), поэтому молекула воды полярна.
Пример 7. Длина диполя молекулы равна 3,37 · 10–19 м. Найдите электрический момент диполя молекулы.
> 0), поэтому молекула воды полярна.
Пример 7. Длина диполя молекулы равна 3,37 · 10–19 м. Найдите электрический момент диполя молекулы.
 . Поэтому образуются три ковалентные связи.
. Поэтому образуются три ковалентные связи. , атом образует одну ковалентную связь.
, атом образует одну ковалентную связь.

 .
.

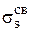 ), другая – разрыхляющая (
), другая – разрыхляющая ( ). Две s-МО получаются также комбинацией двух рх-рх АО (
). Две s-МО получаются также комбинацией двух рх-рх АО (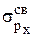 и
и  ). Комбинацией двух ру-ру и двух рz-pz АО образуются две pсв-МО (
). Комбинацией двух ру-ру и двух рz-pz АО образуются две pсв-МО ( и
и  ) и две pраз-МО (
) и две pраз-МО ( и
и  ).
).
 . (2)
. (2)
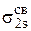 и
и  МО по два электрона с антипараллельными спинами (принцип Паули). Затем шесть электронов разместятся на трех связывающих МО (
МО по два электрона с антипараллельными спинами (принцип Паули). Затем шесть электронов разместятся на трех связывающих МО (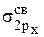 ;
;  ;
;  ) по два электрона с антипараллельными спинами. Оставшиеся два электрона займут разрыхляющие МО (
) по два электрона с антипараллельными спинами. Оставшиеся два электрона займут разрыхляющие МО ( и
и  ) по одному электрону с параллельными спинами согласно правилу Гунда. После размещения электронов на МО энергетическая диаграмма молекулы кислорода будет иметь следующий вид (рис. 7).
) по одному электрону с параллельными спинами согласно правилу Гунда. После размещения электронов на МО энергетическая диаграмма молекулы кислорода будет иметь следующий вид (рис. 7).
 неустойчивая, а ион молекулы
неустойчивая, а ион молекулы  устойчив. Рассчитайте кратность связи в обоих случаях. Как и почему изменяется энергия химической связи при переходе
устойчив. Рассчитайте кратность связи в обоих случаях. Как и почему изменяется энергия химической связи при переходе  и ее иона
и ее иона  . Рассчитайте кратность связи в обоих случаях. Как можно объяснить понижение энергии связи при удалении одного электрона из молекулы
. Рассчитайте кратность связи в обоих случаях. Как можно объяснить понижение энергии связи при удалении одного электрона из молекулы  происходит по схеме: BF3 + F– ®
происходит по схеме: BF3 + F– ®  имеют одинаковую пространственную конфигурацию. Как это можно объяснить с точки зрения гибридизации атомных орбиталей центрального атома? Почему электрический момент диполя молекулы СН4 равен нулю?
имеют одинаковую пространственную конфигурацию. Как это можно объяснить с точки зрения гибридизации атомных орбиталей центрального атома? Почему электрический момент диполя молекулы СН4 равен нулю? и иона
и иона  . Рассчитайте кратность связи в обоих случаях и объясните, почему молекула
. Рассчитайте кратность связи в обоих случаях и объясните, почему молекула  ;
;  ;
;  . Рассчитайте кратность связи и определите, какая из них будет наиболее устойчивой?
. Рассчитайте кратность связи и определите, какая из них будет наиболее устойчивой? ;
;  ;
; 


