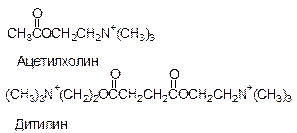Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Белки: строение, свойства и функцииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ 1. Белки и их основные признаки 2. Биологические функции белков 3. Аминокислотный состав белков 4. Классификация белков 5. Физические свойства белков 6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры) Белки и их основные признаки Белки или протеины (что в переводе с греческого означает «первые» или «важнейшие»), количественно преобладают над всеми макромолекулами, присутствующими в живой клетке, и составляют более половины сухого веса большинства организмов. Представления о белках как о классе соединений сформировались в XVII-XIX вв. В этот период из разнообразных объектов живого мира (семена и соки растений, мышцы, кровь, молоко) были выделены вещества, обладающие сходными свойствами: они образовывали вязкие растворы, свертывались при нагревании, при горении ощущался запах паленой шерсти и выделялся аммиак. Поскольку все эти свойства ранее были известны для яичного белка, то новый класс соединений назвали белками. После появления в начале XIX вв. Более совершенных методов анализа веществ определили элементный состав белков. В них обнаружили С, Н, О, N, S. К концу XIX вв. Из белков было выделено свыше 10 аминокислот. Исходя из результатов изучения продуктов гидролиза белков, немецкий химик Э.Фишер (1852-1919) предположил, что белки построены из аминокислот. В результате работ Фишера стало ясно, что белки представляют собой линейные полимеры a-аминокислот, соединенных друг с другом амидной (пептидной) связью, а все многообразие представителей этого класса соединений могло быть объяснено различиями аминокислотного состава и порядка чередования разных аминокислот в цепи полимера. Первые исследования белков проводились со сложными белковыми смесями, например: с сывороткой крови, яичным белком, экстрактами растительных и животных тканей. Позже были разработаны методы выделения и очистки белков, такие как осаждение, диализ, хроматография на целлюлозных и других гидрофильных ионообменниках, гель-фильтрация, электрофорез. Более подробно рассмотрим эти методы на лабораторной работе и семинарском занятии. На современном этапе основными направлениями изучения белков являются следующие:
¨ изучение пространственной структуры индивидуальных белков; ¨ изучение биологических функций разных белков; ¨ изучение механизмов функционирования индивидуальных белков (на уровне отдельных атомов, атомных групп молекулы белка). Все эти этапы взаимосвязаны, ведь одна из основных задач биохимии как раз и состоит в том, чтобы понять, каким образом аминокислотные последовательности разных белков дают им возможность выполнять различные функции. Биологические функции белков Ферменты - это биологические катализаторы, самый многообразный, многочисленный класс белков. Почти все химические реакции, в которых участвуют присутствующие в клетке органические биомолекулы, катализируются ферментами. Настоящему времени открыто более 2000 различных ферментов. Транспортные белки - Транспортные белки плазмы крови связывают и переносят специфические молекулы или ионы из одного органа в другой. Например, гемоглобин, содержащийся в эритроцитах, при прохождении через легкие связывает кислород и доставляет его к периферическим тканям, где кислород освобождается. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует еще один клеточный тип транспортных белков, способных связывать определенные молекулы (напр., глюкозу) и переносить их через мембрану внутрь клетки. Пищевые и запасные белки. Наиболее известными примерами таких белков служат белки семян пшеницы, кукурузы, риса. К пищевым белкам относится яичныйальбумин - основной компонент яичного белка, казеин - главный белок молока. Сократительные и двигательные белки. Актин и миозин - белки, функционирующие в сократительной системе скелетной мышцы, а также во многих немышечных тканях. Структурные белки. Коллаген - главный компонент хрящей и сухожилий. Этот белок имеет очень высокую прочность на разрыв. Связки содержат эластин - структурный белок, способный растягиваться в двух измерениях. Волосы, ногти состоят почти исключительно из прочного нерастворимого белка - кератина. Главным компонентом шелковых нитей и паутины служит белок фиброин. Защитные белки. Иммуноглобулины или антитела - это специализированные клетки, вырабатываемые в лимфоцитах. Они обладают способностью распознавать проникшие в организм бактерии вирусы или чужеродные молекулы, а затем запускать систему их нейтрализации. Фибриноген и тромбин - белки, участвующие в процессе свертывания крови, они предохраняют организм от потери крови при повреждении сосудистой системы.
Регуляторные белки. Некоторые белки участвуют в регуляции клеточной активности. К ним относятся многие гормоны, такие как инсулин (регулирует обмен глюкозы). Классификация белков По растворимости Альбумины. Растворимы в воде и солевых растворах. Глобулины. Слаборастворимы в воде, но хорошо растворимы в солевых растворах. Проламины. Растворимы в 70-80% этаноле, нерастворимы в воде и абсолютном спирте. Богаты аргинином. Гистоны. Растворимы в солевых растворах. Склеропротеины. Нерастворимы в воде и солевых растворах. Повышено содержание глицина, аланина, пролина. По форме молекул Если исходить из отношения осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков отношение составляет меньше 10 и в большинстве случаев не превышает 3-4. Они характеризуются компактной упаковкой полипептидных цепей. Примеры глобулярных белков: многие ферменты, инсулин, глобулин, белки плазмы крови, гемоглобин. Фибриллярные белки, у которых отношение осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями (кератин, миозин, коллаген, фибрин). Физические свойства белков На физических свойствах белков, таких как ионизация, гидратация, растворимость основаны различные методы выделения и очистки белков. Так как белки содержат ионогенные, т.е. способные к ионизации аминокислотные остатки (аргинин, лизин, глутаминовая кислота и т.д.), следовательно, они представляют собой полиэлектролиты. При подкислении степень ионизации анионных групп снижается, а катионных - повышается, при подщелачивании наблюдается обратная закономерность. При определенном рН число отрицательно и положительно заряженных частиц становится одинаковым, такое состояние называется изоэлектрическим (суммарный заряд молекулы равен нулю). Значение рН, при котором белок находится в изоэлектрическом состоянии, называют изоэлектрической точкой и обозначают рI. На различной ионизации белков при определенном значении рН основан один из методов их разделения - метод электрофореза. Полярные группы белков (ионогенные и неионогенные) способны взаимодействовать с водой, гидратироваться. Количество воды, связанное с белком достигает 30-50 г на 100 г белка. Гидрофильных групп больше на поверхности белка. Растворимость зависит от количества гидрофильных групп в белке, от размеров и формы молекул, от величины суммарного заряда. Совокупность всех этих физических свойств белка позволяет использовать метод молекулярных сит или гель-фильтрацию для разделения белков. Метод диализа используется для очистки белков от низкомолекулярных примесей и основан на больших размерах молекул белка. Растворимость белков зависит и от наличия других растворенных веществ, например, нейтральных солей. При высоких концентрациях нейтральных солей белки выпадают в осадок, причем для осаждения (высаливания) разных белков требуется разная концентрация соли. Это связано с тем, что заряженные молекулы белка адсорбируют ионы противоположного заряда. В результате частицы теряют свои заряды и электростатическое отталкивание, в результате происходит осаждение белка. Методом высаливания можно фракционировать белки.
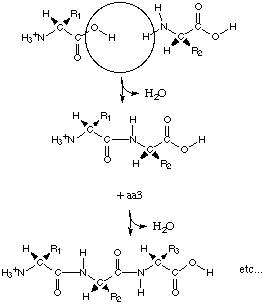
Первичная структура белков
Первичной структурой белка называют состав и последовательность аминокислотных остатков в белковой молекуле. Аминокислоты в белке связаны пептидными связями. Все молекулы данного индивидуального белка идентичны по аминокислотному составу, последовательности аминокислотных остатков и длине полипептидной цепи. Установление последовательности аминокислотной последовательности белков - трудоемкая задача. Более подробно на эту тему мы поговорим на семинаре. Инсулин был первым белком, для которого установили аминокислотную последовательность. Бычий инсулин имеет молярную массу около 5700. Его молекула состоит из двух полипептидных цепей: А-цепи, содержащей 21 а.к., и В-цепи, содержащей 30 а.к., эти две цепи соединены двумя дисульфидными (-S-S-) связями. Даже небольшие изменения первичной структуры могут значительно изменять свойства белка. Болезнь серповидноклеточная анемия является результатом изменения всего 1 аминокислоты в b-цепи гемоглобина (Glu ® Val). Видовая специфичность первичной структуры При изучении аминокислотных последовательностей гомологичных белков, выделенных из разных видов, было сделано несколько важных выводов. К гомологичным белкам относятся те белки, которые у разных видов выполняют одинаковые функции. Примером может служить гемоглобин: у всех позвоночных он осуществляет одну и ту же функцию, связанную с транспортом кислорода. Гомологичные белки разных видов обычно имеют полипептидные цепи одинаковой или почти одинаковой длины. В аминокислотных последовательностях гомологичных белков во многих положениях всегда находятся одни и те же аминокислоты - их называют инвариантными остатками. Вместе с тем в других положениях белков наблюдаются значительные различия: в этих положениях аминокислоты варьируются от вида к виду; такие аминокислотные остатки называются вариабельными. Всю совокупность сходных черт в аминокислотных последовательностях гомологичных белков объединяют в понятие гомология последовательностей. Наличие такой гомологии предполагает, что животные, из которых были выделены гомологичные белки, имеют общее эволюционное происхождение. Интересным примером является сложный белок - цитохром с - митохондриальный белок, учавствующий в качестве переносчика электронов в процессах биологического окисления. М» 12500, содержит»100 а.к. Были установлены а.к. последовательности для 60 видов. 27 а.к. - одинаковы, это указывает на то, что все эти остатки играют важную роль в определении биологической активности цитохрома с. Второй важный вывод, сделанный на основе анализа аминокислотных последовательностей, состоит в том, что число остатков, по которым различаются цитохромы с любых двух видов, пропорционально филогенетическому различию между данными видами. Например, молекулы цитохрома с лошади и дрожжей различаются по 48 а.к., у утки и курицы - по 2 а.к., у курицы и индейки не различаются. Сведения с числе различий в аминокислотных последовательностях гомологичных белков из разных видов используют для построения эволюционных карт, отражающих последовательные этапы возникновения и развития различных видов животных и растений в процессе эволюции.
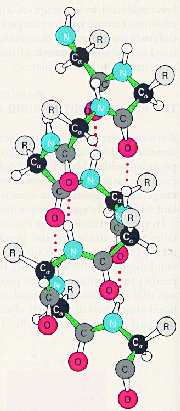
Вторичная структура белков - это укладка белковой молекулы в пространстве без учета влияния боковых заместителей. Выделяют два типа вторичной структуры: a-спираль и b- структуру (складчатый слой). Остановимся более подробно на рассмотрении каждого типа вторичной структуры. a-Спираль представляет из себя правую спираль с одинаковым шагом, равным 3,6 аминокислотных остатков. a-Спираль стабилизируется внутримолекулярными водородными связями, возникающими между атомами водорода одной пептидной связи и атомами кислорода четвертой по счету пептидной связи.
Боковые заместители расположены перпендикулярно плоскости a-спирали.
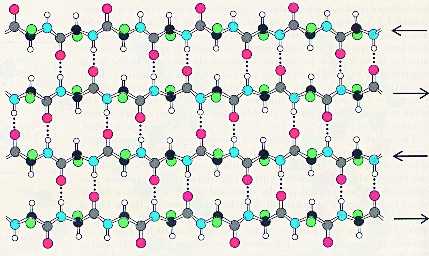
Т.о. свойства данного белка определяются свойствами боковых групп аминокислотных остатков: входящих в состав того или иного белка. Если боковые заместители гидрофобны, то и белок, имеющий структуру a-спираль гидрофобен. Примером такого белка является белок кератин, из которого состоят волосы. В результате получается, что a- спираль пронизана водородными связями и является очень устойчивой структурой. При образовании такой спирали работают две тенденции: ¨ молекула стремится к минимуму энергии, т.е. к образованию наибольшего числа водородных связей; ¨ из-за жесткости пептидной связи сблизиться в пространстве могут лишь первая и четвертая пептидные связи. В складчатом слое пептидные цепи располагаются параллельно друг другу, образуя фигуру, подобную листу, сложенному гармошкой. Пептидных цепей, взаимодействующих между собой водородными связями, может быть большое количество. Расположены цепи антипараллельно.
Чем больше пептидных цепей входит в состав складчатого слоя, тем прочнее молекула белка. Сравним свойства белковых материалов шерсти и шелка и объясним различие в свойствах этих материалов с точки зрения строения белков, из которых они состоят. Кератин - белок шерсти - имеет вторичную структуру a-спираль. Шерстяная нить не такая прочная, как шелковая, легко растягивается в мокром состоянии. Это свойство объясняется тем, что при приложении нагрузки водородные связи рвутся и спираль растягивается.
Фиброин - белок шелка - имеет вторичную b-структуру. Шелковая нить не вытягивается и является очень прочной на разрыв. Это свойство объясняется тем, что в складчатом слое взаимодействуют между собой водородными связями много пептидных цепей, что делает эту структуру очень прочной. Аминокислоты различаются по способности участвовать в образовании a-спиралей и b-структур. Редко встречаются в a-спиралях глицин, аспаргин, тирозин. Пролин дестабилизирует a-спиральную структуру. Объясните, почему? В состав b-структур входит глицин, почти не встречаются пролин, глютаминовая кислота, аспаргин, гистидин, лизин, серин. В структуре одного белка могут находиться участки b-структур, a-спиралей и нерегулярные участки. На нерегулярных участках пептидная цепь может сравнительно легко изгибаться, менять конформацию, в то время, как спираль и складчатый слой представляют собой достаточно жесткие структуры. Содержание b-структур и a-спиралей в разных белках неодинаково. Третичная структура белков определяется взаимодействием боковых заместителей пептидной цепи. Для фибриллярных белков трудно выделить общие закономерности в образовании третичных структур. Что касается глобулярных белков, то такие закономерности существуют, и мы их рассмотрим. Третичная структура глобулярных белков образуется путем дополнительного складывания пептидной цепи, содержащей b-структуры, a-спирали и нерегулярные участки, так, что гидрофильные боковые группы аминокислотных остатков оказываются на поверхности глобулы, а гидрофобные боковые группы спрятаны вглубь глобулы, иногда образуют гидрофобный карман. Силы, стабилизирующие третичную структуру белка. Электростатическое взаимодействие между разно заряженными группами, крайний случай - ионные взаимодействия. Водородные связи, возникающие между боковыми группами полипептидной цепи. Гидрофобные взаимодействия. Ковалентные взаимодействия (образование дисульфидной связи между двумя остатками цистеина с образованием цистина). Образование дисульфидных связей приводит к тому, что удаленные области полипептидной молекулы сближаются и фиксируются. Дисульфидные связи разрушаются под действием восстановителей. Это свойство используется для химической завивки волос, которые почти полностью представляют собой белок кератин, пронизанный дисульфидными связями. Характер пространственной укладки определяется аминокислотным составом и чередованием аминокислот в полипептидной цепи (первичной структурой). Следовательно, каждый белок имеет только одну пространственную структуру, соответствующую его первичной структуре. Небольшие изменения конформации белковых молекул происходят при взаимодействии с другими молекулами. Эти изменения порой играют огромную роль при функционировании белковых молекул. Так, при присоединении молекулы кислорода к гемоглобину несколько изменяется конформация белка, что приводит к эффекту кооперативного взаимодействия при присоединении остальных трех молекул кислорода. Такое изменение конформации в лежит в основе теории индуцирующего соответствия при объяснении групповой специфичности некоторых ферментов. Кроме ковалентной дисульфидной все остальные связи, стабилизирующие третичную структуру, являются по своей природе слабыми и легко разрушаются. При разрыве большого числа связей, стабилизирующих пространственную структуру белковой молекулы, упорядоченная уникальная для каждого белка конформация нарушается, при этом часто теряется биологическая активность белка. Такое изменение в пространственном строении называется денатурацией. Ингибиторы функций белков Учитывая, что различные лиганды отличаются Ксв, всегда можно подобрать вещество, похожее по структуре на природный лиганд, но имеющий большее значение Ксв с данным белком. Например, СО имеет Ксв в 100 раз больше, чем О2 с гемоглобином, поэтому достаточно 0,1% СО в воздухе, чтобы заблокировать большое количество молекул гемоглобина. По такому же принципу действуют многие лекарства. Например, дитилин.
Ацетилхолин - медиатор передачи нервных импульсов на мышцу. Дитилин блокирует белок-рецептор, с которым связывается ацетилхолин и создает эффект парализации. 9.Связь структуры белков с их функциями на примере гемоглобина и миоглобина Транспорт двуокиси углерода Гемоглобин не только переносит кислород от легких к периферическим тканям, но и ускоряет транспорт СО2 от тканей к легким. Гемоглобин связывает СО2 сразу после освобождения кислорода (» 15 % всего СО2). В эритроцитах происходит ферментативный процесс образования угольной кислоты из СО2, поступающего из тканей: СО2 + Н2О = Н2СО3. Угольная кислота быстро диссоциирует на НСО3- и Н+. Для предотвращения опасного повышения кислотности должна существовать буферная система, способная поглощать избыток протонов. Гемоглобин связывает два протона на каждые четыре освободившиеся молекулы кислорода и определяет буферную емкость крови. В легких идет обратный процесс. Высвобождающиеся протоны связываются с бикарбонат- ионом с образованием угольной кислоты, которая под действием фермента превращается в СО2 и воду, СО2 выдыхается. Т.о., связывание О2 тесно сопряжено с выдыханием СО2. Это обратимое явление известно как эффект Бора. У миоглобина эффекта Бора не обнаруживается. Изофункциональные белки Белок, выполняющий определенную функцию в клетке, может быть представлен несколькими формами - изофункциональными белками, или изоферментами. такие белки хоть и выполняют одинаковую функцию, но отличаются, константой связывания, что приводит к некоторым различиям в функциональном отношении. Например, в эритроцитах человека обнаружено несколько форм гемоглобина: HbA (96%), HbF (2%), HbA2(2%). Все гемоглобины представляют собой тетрамеры, построенные из протомеров a, b, g, d (HbA -a2b2, HbF - a2g2, HbA2 - a2d2). Все протомеры сходны между собой по первичной структуре, и очень большое сходство наблюдается по вторичной и третичной структурам. Все формы гемоглобинов предназначены для переноса кислорода в клетки тканей, но HbF, например, имеет большее сродство к кислороду, чем HbA. HbF характерен для эмбриональной стадии развития человека. Он способен отнимать кислород у HbA, что обеспечивает нормальное снабжение кислородом плода. Изобелки - это результат наличия более чем одного структурного гена в генофонде вида.
БЕЛКИ: СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ 1. Белки и их основные признаки 2. Биологические функции белков 3. Аминокислотный состав белков 4. Классификация белков 5. Физические свойства белков 6. Структурная организация белковых молекул (первичная, вторичная, третичная структуры)
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 3393; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.192.113 (0.015 с.) |