
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Степень окисления (СО) атомов некоторых элементовСодержание книги
Поиск на нашем сайте
Пример 1. Определите, используя таблицу, степень окисления (СО): хрома в К2Cr2O7. Серы в сульфите-ионе SO32 2 – .
Решение. Степень окисления – это условный заряд атома в молекуле химического соединения, который определяется из допущения, что общая электронная пара в молекуле полностью смещена в сторону более электроотрицательного атома. Молекула же в целом электронейтральна. Определяем степень окисления хрома, если степень окисления калия +1, а степень окисления кислорода – 2.
СО хрома равна +6. Аналогично определяем СО серы в сульфит-ионе, заряд которого равен – 2.
Степень окисления серы в сульфит-ионе равна +4. Пример 2. Определите, какие из нижеприведенных реакций: a) Zn + H2CO4(разб) = ZnSO4 + H2↑; б) ZnO + CO2 = ZnCO3; в) MnO2 + Al = Al2O3 + Mn. являются окислительно-восстановительными. Укажите окислитель и восстановитель. Процессы окисления и восстановления. Расставьте коэффициенты, используя метод электронного баланса. Решение. В окислительно-восстановительных реакциях изменяются степени окисления атомов элементов реагирующих веществ. Находим СО всех атомов в реакции а):
Изменились СО атомов элементов цинка и водорода, следовательно, реакция а) окислительно-восстановительная. Произошли следующие изменения: 30Zn2+ 1s22s22p63s23p63d104s2, 30Zn0 1s22s22p63s23p63d104s0. Как видно из электронных формул, атом цинка отдал два электрона. СО его повысилась: Zn0 – 2ē = Zn2+ восстановительная окисленная форма форма Атом, молекула или ион, отдающий электроны, называется восстановителем, а процесс отдачи электронов называется окислением. Восстановитель – Zn окисляется. Водород-ион принял один электрон Н0, степень окисления его понизилась:
2Н+ + 2ē = Н2 0 окисленная восстановительная форма форма Атом, молекула или ион, принимающий электроны, называется окислителем, а процесс отдачи электронов называется восстановлением. Окислитель – (Н+) восстанавливается. В любой окислительно-восстановительной реакции число электронов, отданных восстановителем, равно числу электронов, принятых окислителем, т.е. устанавливается электронный баланс:
В реакции б) СО элементов не меняется:
следовательно, эта реакция не окислительно-восстановительная. В реакции в) изменяются степени окисления атомов реагирующих веществ:
реакция окислительно-восстановительная. Подберем коэффициенты в уравнения методом электронного баланса:
Для подбора коэффициентов находим наименьшее кратное числу электронов, участвующих в реакции. Это наименьшее кратное (12) делим на число электронов, отданных восстановителем (3) и принятых окислителем (4), получаем соответствующие коэффициенты перед окислителем и восстановителем в данной реакции: 4Al + 3MnO2 = 2Al2O3 + 3Mn. В сложных реакциях перед веществами, атомы которых не меняют СО, коэффициенты находят подбором. Пример 3. Определите, исходя из степени окисления азота: а) какие частицы N2 0, NН4 +, NO3 – , NO2 – могут проявлять свойства только восстановителя, только окислителя, окислителя и восстановителя; б) укажите, что представляет собой каждый из процессов: 1) N2 0®NO; 2) NH4 + ® NH3; 3) NO2–®NO3 –; 4) NO3 –®NH4 + . Решение. Определим СО азота в предложенных частицах: N2 0 ; Строение нейтрального атома азота следующее: 7N0 1s22s22p3. На внешнем энергетическом уровне атома пять электронов. В частице NH4 + СО атома азота равна – 3, 7N–3 1s22s22p6), т.е. на внешнем энергетическом уровне максимальное количество электронов – восемь. Такая частица может только отдавать электроны, т.е. окисляться, следовательно, проявляет только восстановительные свойства. В ионе NO3 –; азот проявляет высшую положительную СО, равную +5, 7N+5 1s22s02p0. Такая частица может принимать электроны, т.е. восстанавливаться, поэтому проявляет только окислительные свойства. В N20 и Процесс перехода: 1) N2 0®NO, СО азота повысилась от 0 до +2, атом азота отдает 2 электрона, процесс окисления. 2) N20® 3) 4) Пример 4. Составьте уравнение окислительно-восстановительной реакции, идущей по схеме:
Подберите коэффициенты электронно-ионным методом. Решение. Для подбора коэффициентов в реакциях, протекающих в растворах электролитов, удобно использовать метод электронно-ионного баланса. 1. Из уравнения реакции видно, что Mg меняет СО от 0 до +2. т.е. он окисляется и является восстановителем. Сера изменяет СО от +6 до –2, т.е. она восстанавливается и является окислителем. 2. Записываем ионно-молекулярное уравнение реакций: Mg0 + 2H+ + SO42 2– ®Mg2+ + SO42 2–+ H2O. H2SO4 и MgSO4 – сильные электролиты, H2O – слабый электролит, H2S – газообразное вещество. 3. Записываем уравнения для процесса окисления: восстановитель Mg0 – 2ē = Mg2+ окисляется. 4. Уравняем число атомов магния. В левой и правой частях уравнения реакции их по одному. 5. Количество атомов уравнено, поэтому подсчитываем сумму зарядов в левой и правой частях уравнения: уравнение: Mg0 ® Mg2+ заряды 0 +2 сумма зарядов 0 +2 В левой части 2 избыточных отрицательных заряда, поэтому отнимаем 2 электрона и получаем: Mg0 – 2ē ® Mg2+. 6. Проверяем количество отданных электронов по изменению СО магния: 0 ® +2. 7. Записываем уравнения для процесса восстановления, на основании ионного уравнения: SO42 2– ® H2S окисленная восстановленная форма форма Атомов серы в правой и левой частях по одному. Уравниваем атомы кислорода. В левой части их 4, а в правой – 0. Избыточные 4 атома кислорода в левой части уравнения реакции образовали четыре молекулы Н2О. SO42 2– ® H2S + 4Н2О. Наконец, уравниваем атомы водорода. В правой части их 10, в левой их нет. Ионно-молекулярное уравнение показывает, что они содержатся в виде Н+– ионов. Добавляем в левую часть 10 ионов Н+: SO42 2– + 10Н+ ® H2S + 4Н2О. В кислой среде всегда «избыток» кислорода связывается ионами среды, каждый атом кислорода связывается двумя ионами Н+, образуя молекулу Н2О. 8. Количество атомов всех элементов уравнено, подсчитываем сумму зарядов в правой и левой частях уравнения: уравнение: SO42 2– + 10Н+ ® H2S + 4Н2О
сумма зарядов +8 0 В левой части 8 избыточных положительных зарядов, поэтому добавляем сюда 8 электронов. Окончательно получается: SO42 2– + 10Н+ + 8ē ® H2S + 4Н2О. 9. Проверяем число принятых электронов по изменению СО серы: +6 ® –2. В итоге получаем следующую систему уравнений:
10. Находим коэффициенты для процессов окисления и восстановления, используя общее правило. Число отданных и принятых электронов равно 2 и 8. Наименьше кратное – 8, отсюда коэффициенты: для процесса окисления 4, для процесса восстановления – 1. Проверяем: отдается (2 · 4) восемь электронов, принимается также восемь. Складываем электронные уравнения процессов окисления и восстановления почленно и получаем полное ионно-молекулярное уравнение реакции: 2Mg0 + SO42 2– + 10Н+ ® 4Mg2+ + H2S + 4Н2О. 11. Перенесем полученные коэффициенты в молекулярное уравнение: 4Mg + 5H2SO4 ® 4MgSO4 + H2S + 4Н2О. Эти же коэффициенты можно получить методом электронного баланса:
Mg0 + S+6 ® Mg2+ + S2– 4Mg + 5H2SO4 ® 4MgSO4 + H2S + 4Н2О. Пример 5. Расставьте коэффициенты в уравнении реакции, идущей по схеме: K[Cr(OH)4] + Cl2 + KOH ® K2CrO4 + KCl + H2O. Решение. 1. Находим окислитель и восстановитель в реакции и записываем ионно-молекулярное уравнение. В него должны войти частицы, содержащие окислитель и восстановитель, частицы – продукт окисления и восстановления, а также ионы и молекулы среды, участвующие в реакции:
восстановитель окислитель 2. Записываем уравнения для процесса окисления восстановителя, в котором уравниваем число атомов хрома, кислорода и водорода: [Cr(OH)4]–® CrO42 2–. В правой и левой частях уравнения по одному атому хрома, по четыре атома кислорода. Освободившиеся четыре иона водорода в левой части уравнения связываются четырьмя ионами ОН– щелочной среды, образуя молекулы воды: 4Н++ 4ОН–® 4H2O. Для процесса окисления получаем: [Cr(OH)4]–+ 4OH– ® CrO42 2– + 4H2O. 3. Подсчитываем сумму зарядов в левой и правой частях уравнения и определим число электронов, отданных восстановителем:
сумма зарядов –5 –2 Поскольку в левой части уравнения на три отрицательных заряда больше, вычитаем три электрона: [Cr(OH)4]–+ 4OH–– 3ē ® CrO42 2– + 4H2O. 4. Проверяем правильность составления процесса окисления по СО хрома: хром меняет СО от +3 до +6, следовательно, хром отдает три электрона. 1. Записываем уравнение для процесса восстановления: Cl2 ® Cl– Хлор меняет СО от 0 до –1, т.е. каждый атом хлора принимает по одному электрону: Cl2 + 2 ē ® Cl–. Получаем систему уравнений:
При сложении уравнений процессов окисления и восстановления и подборе коэффициентов получаем ионно-молекулярное уравнение окислительно-восстановительной реакции:
Полученные коэффициенты переносим в молекулярное уравнение: 2K[Cr(OH)4] + 3Cl2 + 8KOH ® 2K2CrO4 + 6KCl + 8H2O. КОНТРОЛЬНЫЕ ЗАДАНИЯ 181. Реакция протекает по схемам: Na2SO3 + KMnO4 + H2SO4 ® Na2SO4 + MnSO4 + K2SO4 + H2O, Zn + HNO3 ® Zn(NO3)2 + NH4NO3 + H2O. разб. Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое восстановителем, какое вещество окисляется, какое восстанавливается. 182. См. формулировку вопроса задачи № 181. K2CrO7 + H2S+ H2SO4 ® Cr2 (SO4)3 + S + H2O + K2SO4, Be + HNO3 ® Be(NO3)2 + NO2 + H2O. конц. 183. См. формулировку вопроса задачи № 181. KMnO4 + Na2SO3+ H2O ® MnO2 + Na2SO4 + KOH, Hg + H2SO4 ® HgSO4 + SO2 + H2O. конц. 184. См. формулировку вопроса задачи № 181. K2S + KMnO4 + H2SO4 ® S + MnSO4 + K2SO4 + H2O, Zn + H2SO4 ® Zn SO4 + H2S + H2O. конц. 185. См. формулировку вопроса задачи № 181.
Mn + HNO3 ® Mn(NO3)2 + NO2 + H2O, разб. KI + KMnO4 + H2SO4 ® I2 + KSO4 + MnSO4 + H2O.
186. См. формулировку вопроса задачи № 181. Cd + HNO3 ® Mn(NO3)2 + NO2 + H2O, конц. MnSO4 + KClO3 + KOH ® K2MnO4 + KCl + K2SO4 + H2O. 187. См. формулировку вопроса задачи № 181. Be + H2SO4 ® BeSO4 + H2S + H2O, конц. KMnO4 + KNO2+ H2SO4 ® MnSO4 + KNO3 + K2SO4 + H2O. 188. См. формулировку вопроса задачи № 181. MnO4 + KNO3+ KOH ® K2MnO4 + KNO2 + H2O, Sn + H2SO4 ® Sn(SO4)2 + SO2 + H2O. конц. 189. См. формулировку вопроса задачи № 181. Mn(NO3)2 + KMnO4 + H2O → MnO2 + KNO3 + HNO3, H2SO4 + HClO4 ® H2SO4 + HCl. 190. См. формулировку вопроса задачи № 181. KMnO4 + NaAsO3 + H2SO4 ® MnSO4 + Na3AsO4 + K2SO4 + H2O, HCl + CrO3 ® Cl2 + CrCl3 + H2O. 191. Определите, какие из перечисленных ниже реакций являются окислительно-восстановительными и расставьте в них коэффициенты: а. CaO + CO2 ® CaCO3; б. K2Cr2O7 + H2SO4 ® CrO3 + K2SO4 + H2O; в. KMnO4 + HBr ® Br2 + KBr + MnBr2 + H2O. 192. Определите, какие из перечисленных ниже реакций являются окислительно-восстановительными и расставьте в них коэффициенты: а. Ca(HCO3)2 + Ca(OH)2 ® CaCO3 + H2O; б. Zn + HNO3 ® Zn(NO3)2 + N2O + N2O + H2O; в. K2Cr2O7 + SnSO4 + H2SO4 ® Cr2(SO4)3 + Sn(SO4)2 + K2SO4 + H2O. 193. Составьте электронные уравнения и укажите, какой процесс – окисления или восстановления происходит при следующих превращениях: а. Mn3+ ® Mn2+; MnO2 ® Mn3+; б. MnO42 2– ® MnO4– ; Mn2+ ® MnO42 2– . На основании электронных уравнений расставьте коэффициенты в уравнениях реакций, идущих по схемам: Cd + H2SO4 ® Cd(SO4)2 + SO2 + H2O; конц. KMnO4 + H3AsO3 + H2SO4 ® MnSO4 + H3AsO4 + K2SO4 + H2O. 194. См. формулировку задачи № 193. a. MnO42 2– ® MnO4– ; SO32 2– ® SO42– ; NO3– ® N22 0; б. Al + HNO3 ® Al(NO3)3 + N2 +H2O; разб. KMnO4 + Na2SO3 + KOH ® K2MnO4 + Na2SO4 + H2O. 195. См. формулировку задачи № 193. a. N2 ® NO; N2 2 ® NH3 ; NO3– ® NH4+ ; б. MnO2 + HCl ® MnCl2 + Cl2 +H2O; конц. Ca + HNO3 → Ca(NO3)2 + NH4NO3 + H2O. разб. 196. См. формулировку задачи № 193. a. Cr2 O72– ® 2Cr3+; NO3– ® NO2; CrO2– ® Cr2 O42– ; б. K2Cr2O7 + HCl ® Cl2 + CrCl2 +H2O; конц. Ni + HNO3 ® Ni(NO3)2 + NO + H2O. разб. 197. См. формулировку задачи № 193. a. Cl5+ ® Cl–; N– ® N5+; Fe3+ ® Fe2+ ; б. Sc + HNO3 ® Sc(NO3)3 + NH4NO3 +H2O; разб. FeSO4 + KClO3 + H2SO4 ® Fe2(SO4)3 + KCl + H2O. 198. а. Определите степени окисления железа в следующих частицах: Fe0; FeOH+; FeO4–; FeO42–. б. На основании электронных уравнений. Расставьте коэффициенты в уравнении реакции, идущей по схеме: FeSO4 + K2Cr2O7 + H2SO4 ® Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O. 199. а. Определите степени окисления серы в следующих частицах: HS–; SO32–; SO42–; S0. б. На основании электронных уравнений, расставьте коэффициенты в уравнениях реакций, идущих по схемам: K2Cr2O7 + K2S + H2SO4 ® Cr2(SO4)3 + S + K2SO4 + H2O; Cu + HNO3 ® Cu(NO3)2 + NO + H2O. разб. 200. а. Определите степени окисления титана в следующих частицах: Ti0; TiOH2+; TiO32–; TiO2+. б. На основании электронных уравнений, расставьте коэффициенты в уравнениях реакций, идущих по схемам: Ti + H2SO4 ® TiSO4 +S0 + H2O; конц. Cd + KMnO4 + H2SO4 ® CdSO4 + K2SO4 + MnSO4 + H2O.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 330; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.105.155 (0.009 с.) |

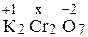 : +2 + 2х – 14 = 0; 2х = 12; х = 6.
: +2 + 2х – 14 = 0; 2х = 12; х = 6.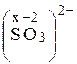 : х – 6 = –2; х = 4.
: х – 6 = –2; х = 4.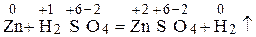 .
.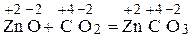 .
.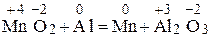 .
. ;
; 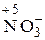 ;
; 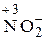 .
.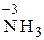 , СО азота понизилась от 0 до –3, процесс восстановления, принимается 3 электрона.
, СО азота понизилась от 0 до –3, процесс восстановления, принимается 3 электрона.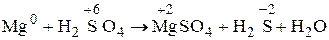 .
.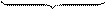
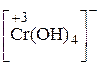 + Cl2 + OH– ®
+ Cl2 + OH– ®  + Cl–+ H2O.
+ Cl–+ H2O.
 уравнение [Cr(OH)4]–+ 4OH–® CrO42 2– + 4H2O
уравнение [Cr(OH)4]–+ 4OH–® CrO42 2– + 4H2O
 2[Cr(OH)4]–+ 8OH–– 6ē + 3Cl2 + 6ē ® 2CrO42 2– + + 6Cl–+ 8H2O.
2[Cr(OH)4]–+ 8OH–– 6ē + 3Cl2 + 6ē ® 2CrO42 2– + + 6Cl–+ 8H2O.


