
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жёсткость воды и методы её устраненияСодержание книги
Поиск на нашем сайте
Жёсткость воды обусловлена присутствием в ней ионов Са2+ и Mg2+. 0бщая жёсткость воды равна сумме временной (карбонатной) и постоянной (некарбонатной) жёсткости. Временная жёсткость связана с наличием гидрокарбонатов кальция и магния Са(НСО3)2 и Мg(НСО3)2. Постоянная – вызвана наличием хлоридов, сульфатов кальция и магния CaCl2, MgCl2, CaSO4, MgSO4. Жёсткость воды выражают суммой миллимоль (ммоль) ионов Са2+ и Mg2+содержащихся в 1 литре воды. Один миллимоль жёсткости отвечает содержанию 20,04 мг/л Са2+ и 12,16 мг/л Mg2+ (ранее жёсткость воды выражали в мэкв/л: 1 мэкв/л = 1 ммоль/л). Жёсткость воды может быть рассчитана по формуле, представленной в общем виде:
где Ж – жёсткость воды, ммоль/л; mi – масса катионов (или соответствующих солей), мг; Мэк i – молярная масса эквивалентов катионов (или соответствующих им солей), мг/ммоль; V – объём воды, л. Для умягчения воды применяют методы осаждения и ионного обмена. Путем осаждения катионы Са2+ и Mg2+ переводят в малорастворимые соединения выпадающие в осадок. Это можно достичь кипячением или химическим путем – введением в воду, например, соды Nа2СО3, гашёной извести Са(ОН)2 и т.д. При кипячении устраняется только временная (карбонатная) жёсткость по реакции: Сa(HCO3)2 Mg(HCO3)2 При разложении Mg(HCO3)2 образуется Mg(OH)2, а не MgCO3 так как 1.Определение жёсткостиводы по массе содержащихся в ней солей. Пример 1. Рассчитайте общую жёсткость воды (ммоль/л}, если в 0,20 л воды содержится 32,42 мг гидрокарбоната кальция Са(НСО3)2; 1,46 мг гидрокарбоната магния Mg(HCО3)2; 22,20 мг хлорида кальция CaCl2 и 4,75 мг хлорида магния MgCl2. Решение. Общая жёсткость воды может быть рассчитана по формуле (1)
Массы солей и объём воды известны по условию задачи. Находим молярные массы эквивалентов солей. Молярная масса эквивалентов соли равна молярной массе соли, деленной на эквивалентное число Z. Для всех солей Z равно 2. Поэтому: Mэк Са(НСО3)2 = М Са(НСО3)2/2 = 162,11/2 - 81,05 мг/ммоль; Mэк Mg(HCO3)2 = M Mg(HCO3)2/2 = 146,34/2 = 73,17 мг/ммоль; Mэк СаСl2 = М СаС12/2 = 110,99/2 = 55,49 мг/ммоль; Mэк MgCl2 =M MgCl2/2 - 95,21/2 = 47,60 мг/ммоль. Подставляя в формулу массы, молярные массы эквивалентов солей и объём воды, рассчитываем общую жёсткость воды:
=2,0 + 0,1 + 2,0 + 0,5 = 4,6 ммоль/л. Пример 2. Вычислите временную жёсткость воды, зная, что в 500 л её содержится 162,1 г Са(НСО3)2. Решение. Временную жёсткость воды можно найти по формуле (1), подставив в неё массу, молярную массу эквивалентов Са(НСО3) 2 и объём воды. Молярная масса эквивалентов Са(НСОз)2 равна 81,05 мг/ммоль (см. пример 1), масса этой соли равна 162100 мг, объем воды 500 л. Следовательно,
2. Определение содержания солей в воде по жёсткости воды Пример 3; Сколько граммов СаСl2 содержится в 100 л воды, если жесткость воды, вызванная этой солью, равна 2,5 ммоль/л? Решение. Массу соли СаСl2 можно найти по формуле (1). А именно:
Подставляя в формулу жёсткость воды, молярную массу эквивалентов CaCl2 (см. пример 1) и объем воды, получаем: M CaCl2 = 2,5 · 55,49 · 100 = 13872,5мг или 13,8725 г. 3. Определение массы реагента, необходимого для устранения жёсткости воды. Пример 4. Сколько граммов соды Nа2СО3 надо прибавить к 150 л воды, чтобы устранить жёсткость, равную 5 ммоль/л? Решение. В 150 л воды содержится 150 · 5 = 750 ммоль/л солей, вызывающих жёсткость воды. По закону эквивалентов для устранения этой жёсткости необходимо добавить такое же количество вещества эквивалентов, умягчающих воду, т.е. 750 ммоль Na2CО3. Для нахождения вещества в граммах количество вещества эквивалентов умножают на молярную массу эквивалентов этого вещества. В данном случае эквивалентное число Na2CO3 равно двум, и молярная масса эквивалентов Na2CО3 будет МэкNа2СО3 = М Nа2СО3/2 = 106/2 = 53 мг/ммоль. Находим массу Na2CO3: m Na2CO3 = nэк Na2CO3 Мэк Na2CO3 = 750 · 53 = 39750 мг или 39,75 г. Эту же задачу можно решить, используя формулу (1). Для этого необходимо помнить, что по закону эквивалентов массы реагирующих веществ пропорциональны их молярным массам эквивалентов. Поэтому в формулу (1) вместо молярной массы эквивалентов солей, вызывающих жёсткость, можно подставить молярную массу эквивалентов веществ, необходимых для устранения этой жёсткости, чтобы найти их массу. В данном случае: m Na2CO3 = Ж · МэкNa2СО3 · V. Подставляя значения Ж, МэкNa2CO3 и V, получаем: m Na2CO3 = 5 ·53 · 150 = 39750 мг или 39,75 г. 4. Определение временной (карбонатной) жёсткости воды по объёму соляной кислоты, пошедшей на её титрование Методом титрования можно определить временную жесткость воды. При этом происходит следующая реакция: Ме(НСО3) 2 + 2 НС1 = МеС12 + 2 Н2О + 2СО2, где Me – Са2+, Mg2+, Fe2+. Согласно закону эквивалентов, количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Отсюда:
(л) первого раствора; Cэк2 и V2 – молярная концентрация эквивалентов вещества (моль/л) и объём (л) второго раствора; Пример 5. Определите временную жёсткость воды, если на титрование 5 · 10–2 л воды, содержащей гидрокарбонат кальция, израсходовано 1,44 · 10–3 л 1,15н раствора HCl. Решение. По условию задачи молярная концентрация эквивалентов Сa(HCO3)2 неизвестна. Обозначим её через х.Подставляя значения в формулу (2), получаем: х · 5· 10–2 = 1,44 · 10–3 · 0,15. Отсюда:
Таким образом, молярная концентрация эквивалентов Сa(HCO3)2 равна 0,004н, что соответствует содержанию Сa(HCO3)2 0,004 моль/л или 4 ммоль/л. Следовательно, временная жёсткость воды составляет 4 ммоль/л. Пример 6. Чему равна временная жесткость воды, если на титрование 100 мл этой воды, содержащей гидрокарбонат железа (II), израсходовано 5,75 мл 0,07 н раствора HCl. Решение. Данная задача решается аналогично тому, как это показано в примере 5, предварительно переведя объёмы растворов в литры, т.е. V1 = 0,1 л H2O; V2 = 5,75 · 10–3 л HCl. Подставляя значения в формулу (2), получаем: х · 0,1 = 5,75 · 10–3 · 0,07. Отсюда:
Молярной концентрации эквивалентов Fe(HCO3)2 соответствует содержание этой соли, равной 4 · 10–3 моль/л или 4 ммоль/л. Следовательно, жёсткость воды 4 ммоль/л. КОНТРОЛЬНЫЕ ЗАДАНИЯ 261.Вода объемом 1 л содержит 38,0 мг гидрокарбоната кальция и 19,6 мг сульфата магния. Чему равна общая жёсткость воды? Ответ: 0,8 ммоль/л. 262.Чему равна жёсткость воды, содержащая 0,01 моль/л хлорида кальция? Ответ: 20 ммоль/л. 263.Чему равна постоянная жесткость воды, если в 2,5 л ее содержится 40 мг сульфата кальция? Ответ:. 0,23 ммоль/л. 264.Чему равна общая жёсткость воды, если в 3,4 л ее находится 57 мг гидрокарбоната магния и 33 мг сульфата кальция? Ответ: 0,37 ммоль/л. 265.При кипячении 0,25 л воды, содержащей только гидрокарбонат кальция, в осадок выпадает 4мг карбоната кальция. Чему равна временная жёсткость воды? Ответ: 0,32 ммоль/л. 266.Сколько граммов сульфата магния содержится в 150 л воды, если жёсткость воды, вызванная этой солью равна 4,7 ммоль/л? Ответ: 42,441г. 267.При кипячении 0,5 л воды, содержащей только гидрокарбонат железа (II). восадок аыпадает 8 мг карбоната железа (II). Чему равна временная жёсткость зоны? Ответ: 0,28 ммоль/л. 268.На титрование 25 мг воды израсходовано 2,4 мл 0,1н раствора НС1. Чему равна карбонатная жёсткость воды? Ответ: 9,6 ммоль/л. 269.Для умягчения 200 л воды потребовалось 12,72 г карбоната натрия. Чем равна жёсткость воды? Ответ: 1,2ммоль/л. 270.Временная жёсткость воды равна 6,64 ммоль/л. Какую массу гидроксида кальция надо взять, чтобы устранить жёсткость 10 л воды. Ответ: 2,459г. 271.Сколько граммов ортофосфата натрия надо прибавить к 250 л воды, чтобы устранить ее карбонатную жёсткость, равную 2.5 ммолъ/л? Ответ: 34,162 г. 272.На титрование 40 мл воды израсходовано 5,7 мл 0,12н. раствора НС1. Чему равна карбонатная жёсткость воды? Ответ: 20 ммоль/л. 273. В 500 л воды содержится 70 г сульфата кальция. Чему равна постоянная жёсткость этой воды? Ответ: 2,1 ммоль/л. 274.Чему равна общая жёсткость воды, если в 300 л ее содержится 32,85 г гидрокарбоната кальция и 30,6 г сульфата магния? Ответ: 3,1 ммоль/л. 275.Вода, содержащая только гидрокарбонат кальция, имеет жёсткость 4,2 ммоль/л. Сколько граммов гидрокарбоната кальция содержится в 250 л воды? Ответ: 85,102 г. 276.К 280 л жесткой воды прибавили 62,5 г карбоната натрия. На сколько ммоль/л понизилась жесткость воды? Ответ: 4 ммоль/л. 277.Вода, содержащая только гидрокарбонат магния, имеет жёсткость 7,8 ммоль/л. Какая масса гидрокарбоната магния содержится в 350 л воды? Ответ: 221,266 г. 278. Какую массу гидроксида кальция надо прибавить к 150 л воды, чтобы устранить временную – жёсткость воды, равную 2,5 ммоль/л? Ответ: 13,89 г. 279. На титрование 40 мл воды потребовалось 3,85 мл 0,15 к раствора НС1. Чему равна карбонатная жёсткость воды? Ответ: 14,4 ммоль/л. 280.Чему равна жёсткость воды в 10 л которой содержится 0,025 моль сульфата магния? Ответ: 5 ммоль/л.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Коровин Н.В. Общая химия: Учеб. Для технических направ. и спец. вузов.– М.: Высш. шк., 1998. – 559 с. 2. Глинка Н.П. Общая химия. – Л.: Химия, 1983 и все последующие издания. 3. Лучинский Г.П. Курс химии. – М.: Высш. шк., 1985. – 461 с. 4. Фролов В.В. Химия. – М.: Высш. шк., 1986. – 543 с. 5. Харин А.И., Катаева Н.А., Харина Л.Т. Курс химии. – М.: Высш. шк., 1983. – 511 с. 6. Хомченко Г.П. Химия для поступающих в вузы: Учебное пособие. – М.: Высш. шк., 1985. – 367 с. 7. Зайцев О.С. Химия. Современный краткий курс: Учебное пособие. – М.: Агар, 1997. – 416 с. 8. Руководство по лабораторным работам по общей химии: Учебное пособие / И.В. Крюкова, Л.А. Сидоренкова, Г.П. Животовская, В.А. Смолко; Под ред. З.Я. Иткиса. – Челябинск: ЧГТУ, 1997. – Ч. I. – 84 с. 9. Лабораторные работы по общей химии: Методические указания /Составители: К.И. Боровская, Р.С. Ванин, И. Д. Зенчурина и др.; Под ред. Ю.П. Васина. – Челябинск: ЧПИ, 1984. – Ч. II. – 61 с. 10. Руководство к лабораторным работам по общей химии: Учебное пособие/ Г.П. Животовская, И.В. Крюкова, В.А. Смолко и др.; Под ред. З.Я. Иткиса. – Челябинск: ЧГТУ, 1997. – Ч. III. – 54 с.
ПРИЛОЖЕНИЕ Таблица П1
Стандартные энтальпии образования ΔH0298, стандартные энтропии S0298 и стандартные энергии Гиббса DG0298 некоторых веществ*
_________ *Данные DH0298, S0298 и DG0298 взяты в основном из работы “Краткий справочник физико-химических величин” / Под ред. А.А. Равделя и Пономарёвой. – Л.: Химия, 1983.
Органические соединения
Таблица П2 Длина связи (d)
Таблица П3 Энергия связи (DH)
Таблица П4 Электроотрицательность элементов ЭО ( c )
Таблица П5
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 2765; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.32.252 (0.009 с.) |

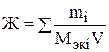 , (1)
, (1) CaCO3¯ + CO2 + H2O.
CaCO3¯ + CO2 + H2O.
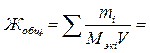
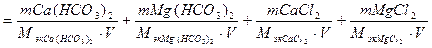 .
.
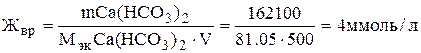 .
.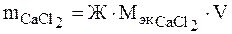 .
.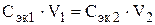 , (2)
, (2)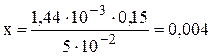 н.
н.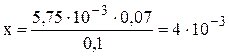 н.
н. N
N



