
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стационарное и квазистационарное протекание реакцийСодержание книги
Поиск на нашем сайте
Одной из основных задач химической кинетики является установление кинетического уравнения сложной реакции на основе ее механизма. Однако, для математического описания кинетики сложных реакций, включающих несколько параллельно-последовательных стадий с образованием промежуточных веществ, приходится составлять и решать систему дифференциальных уравнений. Решение таких систем чаще всего можно провести только численными методами с использованием ЭВМ. В химии часто приходится сталкиваться с реакциями, в которых промежуточные частицы обладают столь высокой реакционной способностью, что не могут накапливаться в системе в концентрациях, соизмеримых с концентрациями исходных веществ и продуктов реакции. Такими процессами являются практически все каталитические процессы и процессы, протекающие с участием промежуточных свободных радикалов (радикально-цепные реакции). Важной особенностью процессов, идущих с участием промежуточных частиц, является установление в системе за малый промежуток времени (промежуток времени, в течение которого относительное изменение концентрации исходных веществ невелико) режима, при котором разность скоростей образования Стационарному режиму отвечают условия:
где n – число промежуточных активных веществ. Стационарный режим протекания реакции можно установить, например, в реакторе идеального смешения, поддерживая постоянной концентрацию исходного вещества путем непрерывной подачи раствора постоянной концентрации. Для того, чтобы стационарный режим устанавливался достаточно быстро и затем сохранялся, промежуточные вещества должны быть активными, то есть продолжительность их жизни должна быть небольшой, по сравнению со временем протекания реакции. При этом их концентрации будут достаточно малы. Метод стационарных концентраций состоит в том, что в системе кинетических уравнений, описывающих сложные химические процессы, скорости по активным частицам принимаются равными нулю.
Это позволяет заменить систему дифференциальных уравнений для концентраций промежуточных частиц алгебраическими уравнениями, выражающими равенство скоростей образования и расходования этих частиц. Таким образом, в кинетических уравнениях для скорости протекания сложной реакции остаются лишь концентрации аналитически определяемых веществ. Система кинетических уравнений существенно упрощается, а решение такой системы облегчается. Метод кинетического расчета с использованием условия (4.116), при постоянстве концентраций исходных веществ, называется методом стационарных концентраций Боденштейна. В качестве примера рассмотрим двухстадийную реакцию, состоящую из двух односторонних стадий первого порядка
Пусть реакция протекает в реакторе идеального смешения, причем концентрация исходного вещества А поддерживается постоянной путем подачи в систему вещества А извне. Через некоторое время после начала реакции в системе установится стационарный режим и концентрация промежуточного вещества В достигнет промежуточного значения Тогда, Отсюда Для стационарного режима легко получить выражение для
Таким образом, применение принципа стационарных концентраций для описания данной реакции позволило заменить дифференциальное уравнение для Можно рассчитать через какое время после начала реакции установится стационарный режим. В начальный период реакции скорость образования промежуточного вещества В определяется выражением
Разделив переменные, получаем:
Проинтегрировав уравнение (4.121) в пределах от 0 до
Разделив уравнение (4.123) на (4.118), получим:
Как следует из уравнения, формально стационарный режим, при котором
Отсюда, например, при При протекании многостадийных реакций в закрытых системах концентрации промежуточных веществ не могут оставаться постоянными, так как концентрации исходных веществ уменьшаются со временем. Однако для достаточно высокоактивных частиц на протяжении всего процесса разность Можно оценить время достижения квазистационарного режима на примере реакции
при условии ее протекания в закрытой системе, то есть когда концентрация исходного вещества уменьшается во времени. Кинетика этой реакции описана выше. Зависимость концентрации исходного вещества А и промежуточного вещества В от времени имеет вид:
Условие квазистационарности запишется в виде:
Подставив значение
Тогда
Из уравнения (4.130) следует, что при Но при
Если реакция состоит из нескольких последовательных стадий (односторонних и двухсторонних), то квазистационарный режим может быть достигнут только при определенных условиях.
|
||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 272; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.85.96 (0.008 с.) |

 и скоростей расходования
и скоростей расходования  промежуточных частиц становится малой по сравнению с самими скоростями. Если поддерживать концентрацию исходных частиц постоянной, то наблюдается равенство скоростей образования и расходования каждой из промежуточных частиц, то есть в системе установится стационарный режим. Такому состоянию системы отвечают стационарные концентрации промежуточных веществ.
промежуточных частиц становится малой по сравнению с самими скоростями. Если поддерживать концентрацию исходных частиц постоянной, то наблюдается равенство скоростей образования и расходования каждой из промежуточных частиц, то есть в системе установится стационарный режим. Такому состоянию системы отвечают стационарные концентрации промежуточных веществ. ;
;  ;
;  ; (
; ( , (4.116)
, (4.116) .
. , то есть скорость образования вещества В будет равна скорости его расходования.
, то есть скорость образования вещества В будет равна скорости его расходования.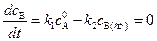 . (4.117)
. (4.117) . (4.118)
. (4.118) :
: ,
,  . (4.119)
. (4.119) на алгебраическое, чем существенно облегчило решение системы уравнений.
на алгебраическое, чем существенно облегчило решение системы уравнений. . (4.120)
. (4.120) . (4.121)
. (4.121) и от 0 до
и от 0 до 
 , получим:
, получим: , (4.122)
, (4.122) . (4.123)
. (4.123) . (4.124)
. (4.124) будет достигнут только при
будет достигнут только при  . Но если задать достаточно малое, но конечное отклонение
. Но если задать достаточно малое, но конечное отклонение  от
от  , то это отклонение окажется достижимым за достаточно короткое время. Например, будем считать близкой к стационарной концентрацию
, то это отклонение окажется достижимым за достаточно короткое время. Например, будем считать близкой к стационарной концентрацию  . Тогда, из уравнения (4.124) находим
. Тогда, из уравнения (4.124) находим . (4.125)
. (4.125)
 , получаем
, получаем  с, то есть время достижения стационарного состояния, при достаточно высоких значениях
с, то есть время достижения стационарного состояния, при достаточно высоких значениях  , оказывается малым.
, оказывается малым. остается малой величиной по сравнению с самими значениями
остается малой величиной по сравнению с самими значениями 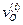 и
и  и концентрации промежуточных частиц близки к их стационарным значениям, отвечающим составу реакционной смеси в рассматриваемый момент времени. Такой режим называется квазистационарным режимом. Очевидно, что для осуществления квазистационарного режима требование высокой активности промежуточных веществ, непродолжительности их жизни и низкой концентрации имеет еще большее значение, чем при стационарном режиме. Только при этих условиях концентрации промежуточных веществ смогут «подстраиваться» к изменяющейся концентрации исходных веществ в каждый момент времени и принимать значения, требуемые для стационарного протекания процесса. В этом случае можно принять, что
и концентрации промежуточных частиц близки к их стационарным значениям, отвечающим составу реакционной смеси в рассматриваемый момент времени. Такой режим называется квазистационарным режимом. Очевидно, что для осуществления квазистационарного режима требование высокой активности промежуточных веществ, непродолжительности их жизни и низкой концентрации имеет еще большее значение, чем при стационарном режиме. Только при этих условиях концентрации промежуточных веществ смогут «подстраиваться» к изменяющейся концентрации исходных веществ в каждый момент времени и принимать значения, требуемые для стационарного протекания процесса. В этом случае можно принять, что  , где
, где  - концентрации промежуточных веществ.
- концентрации промежуточных веществ. (4.126)
(4.126) . (4.127)
. (4.127)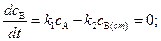
 (4.128)
(4.128) из уравнения (4.126) в (4.128), получим:
из уравнения (4.126) в (4.128), получим: (4.129)
(4.129) (4.130)
(4.130) отношение
отношение  при
при  больше единицы и увеличивается со временем. То есть квазистационарный режим не может быть осуществлен.
больше единицы и увеличивается со временем. То есть квазистационарный режим не может быть осуществлен. можно пренебречь величиной
можно пренебречь величиной 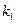 в разности
в разности  и тогда выражение (4.130) переходит в условие (4.124)
и тогда выражение (4.130) переходит в условие (4.124) 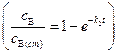 для стационарного процесса, то есть квазистационарный режим может быть реализован. В этом случае, выражение для
для стационарного процесса, то есть квазистационарный режим может быть реализован. В этом случае, выражение для  ,
,  . (4.131)
. (4.131)


