
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Средняя ионная активность и средний коэффициент активностиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Использование активности вместо концентрации ионов позволяет формально учесть всю совокупность взаимодействий (без учета их физической природы), возникающих в растворах электролитов. Этот способ описания взаимодействий применительно к растворам электролитов имеет ряд особенностей. Химический потенциал растворяемой соли (m S) равен:
где a S - активность соли; m S0 - стандартное значение химического потенциала, отвечающее a S =1. Если электролит диссоциирует на n+ катионов и n- анионов, то, исходя из условия электронейтральности, химический потенциал соли связан с химическими потенциалами катионов и анионов соотношением: m S = n+ m+ + n- m--; m S0 = n+ m+ 0+ n- m--0; (1.7) Химический потенциал иона связан с активностью иона соотношением:
где mi - химический потенциал катиона или аниона. Из уравнений (1.5-1.7) следует, что:
или
В связи с тем, что в растворах электролитов одновременно присутствуют и катионы, и анионы растворенного вещества (получить раствор, содержащий только катионы или анионы, невозможно), оценить активность и коэффициент активности отдельного иона невозможно. Поэтому для растворов электролитов вводятся понятия средней ионной активности и среднего ионного коэффициента активности. Для электролита, который диссоциирует на n+ катионов и n- анионов средняя ионная активность электролита a± равна среднему геометрическому из произведения активностей катиона и аниона:
где a + и a - – активность катионов и анионов соответственно; n = n+ + n- - общее число ионов, образующихся при диссоциации молекулы электролита. Например, для раствора Cu(NO3)2:
Аналогично рассчитывается средний коэффициент активности электролита g± и среднее число ионов электролита в растворе n ±: где Например, для электролита KCI=K+ + CI- среднее число ионов в растворе равно n ± = (11·11)1 = 1, то есть в растворе KCI один катион и один анион. Для электролита Al2(SO4)3= 2Al3+ + 3SO42- среднее число ионов в растворе равно n ± = (22·33)1/5=2,56. Это означает, что в расчетах средней активности будет фигурировать одинаковое среднее число катионов и анионов (2,56), отличное от действительного (катионов 2, анионов 3). Обычно среднюю ионную активность и средний ионный коэффициент активности определяют экспериментально (по термодинамическим свойствам растворов): - по повышению температуры кипения раствора; - по понижению температуры замерзания раствора; - по давлению пара растворителя над раствором; - по растворимости малорастворимых соединений, - по методу ЭДС гальванических элементов и др. Среднюю ионную активность и средний ионный коэффициент активности электролита для разбавленных растворов сильных электролитов можно определить теоретически по методу Дебая-Хюккеля. Средняя ионная активность и средний ионный коэффициент активности зависят не только от концентрации раствора, но и от заряда иона. В области низких концентраций средний ионный коэффициент активности определяется зарядом образующих ионов и не зависит от других свойств электролитов. Например, в области низких концентраций g± для растворов KСl, NaNO3, HСl и др. одинаковы. В разбавленных растворах сильных электролитов средний коэффициент активности g± зависит от общей концентрации всех присутствующих в растворе электролитов и зарядов ионов, т.е. g± зависит от ионной силы раствора I. Ионная сила раствора рассчитывается по формуле:
где mi –моляльная (или молярная) концентрация i- того иона; zi - заряд иона. При расчёте ионной силы раствора необходимо учитывать все ионы, находящиеся в растворе. Существует правило ионной силы раствора: в разбавленных растворах коэффициент активности сильного электролита одинаков для всех растворов с одной и той же ионной силой независимо от природы электролита. Это правило справедливо при концентрациях не более 0,02 моль/дм3. В растворах средних и высоких концентраций правило ионной силы трансформируется, так как усложняется характер межионного взаимодействия и проявляются индивидуальные свойства электролитов.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 688; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

 , (1.6)
, (1.6) , (1.8)
, (1.8) = n+
= n+  + n-
+ n-  , (1.9)
, (1.9) . (1.10)
. (1.10) , (1.11)
, (1.11) .
. ; (1.12)
; (1.12)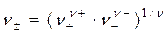 , (1.13)
, (1.13) + и
+ и  , (1.14)
, (1.14)


