
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика фотохимических реакцийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Фотохимия изучает химические процессы, идущие при воздействии света на вещество. Фотохимические реакции называют фотолизом; они могут совершаться в твердых, жидких и газообразных средах. Фотохимические реакции возникают под влиянием видимого света, инфракрасных и ультрафиолетовых лучей с длинами волн от 100 до 1000 нм. Энергия этих квантов равна от 120 до 1200 кДж/моль или от 1,2 до 12 эВ. Поглощение энергии электромагнитных колебаний усиливает вращательное движение молекул или колебания атомов и атомных групп, составляющих молекулу, и может приводить к возбуждению электронов наружных оболочек атомов и появлению активных частиц. Под действием света протекают многие химические процессы. В основе фотохимии лежат два закона. Первый закон фотохимии (Гротгуса – Дрепера) гласит, что только поглощаемое средой излучение может произвести ее химическое превращение. Согласно второму закону фотохимии (Эйнштейна – Штарка), каждый поглощенный квант света в первичном акте способен активировать только одну молекулу. На основе второго закона фотохимии количество энергии Е м, поглощаемой одним молем вещества, определяется по уравнению:
где NA – постоянная Авогадро; h – постоянная Планка; n– частота; с - скорость света; l– длина волны. Если подставить в уравнение (6.18) численные значения постоянных N A, h и с, то:
Большими энергией и химической активностью обладают колебания с меньшей длиной волны. В видимом свете наиболее активными являются фиолетовые лучи с l= 400 нм; для них Е = 297 кДж/моль. Наименее активна красная нить спектра, где l= 750 нм; для нее Е = 159 кДж/моль. Число молей вещества, которое в единицу времени в единице объема активируется под действием радиации и может участвовать в первичной фотохимической реакции, в соответствии с (4.188) можно рассчитать по уравнению:
где Е – световая энергия, которая поглощается единицей объема системы в единицу времени. При опытной проверке закона фотохимической эквивалентности Эйнштейна – Штарка иногда обнаруживается расхождение между числом частиц, которые активируются под действием радиации (числом поглощенных квантов), и числом прореагировавших молекул. Сложность общего течения фотохимических реакций зависит от последующих вторичных реакций, идущих без воздействия света, в связи с чем для характеристики фотохимических процессов введено понятие квантового выхода
Поглощенную энергию Е можно выразить через другие величины. По закону Ламберта – Беера интенсивность I светового потока после прохождения через слой вещества толщиной l равна:
где I 0 – начальная интенсивность светового потока радиации; Отсюда поглощенная энергия Е равна:
Подставляя уравнение (4.192) в (4.190), получим наиболее общее выражение для скорости фотохимической реакции:
Квантовый выход Фотохимия имеет важное применение в процессах синтеза в химической промышленности. Основные преимущества фотохимических реакций заключаются в том, что свет может вызывать высокоселективные реакции, приводящие к образованию продуктов, которые было бы трудно или невозможно получить с помощью термических реакций. Например, если имеется смесь сернистого ангидрида с хлором и углеводородом, то может происходить фотосульфохлорирование. Этот процесс отличается высоким общим квантовым выходом. Продукты реакции – сульфонилхлориды (RSO2Cl) – служат промежуточными продуктами в производстве алкансульфонатов, которые используются в качестве поверхностно-активных соединений и эмульгаторов. Фотохимические процессы лежат в основе производства нейлона. Фотография, открытая Ньепсом (1826) и впервые осуществленная Дагерром (1839), представляет собой также одно из практических применений фотохимических процессов. В основе фотографического процесса лежит способность галогенидов серебра разлагаться под действием света с выделением металлического серебра. Большое значение фотохимические процессы имеют в биологии и медицине. УФ-облучение, например, помогает вылечить многие болезни и повысить защитные силы организма.
Примеры решения задач Пример 1. При инициировании фотохимической реакции необходимая для возбуждения энергия равна 126 кДж/моль. Определите численные значения величин, соответствующих этой энергии: частоту света, волновое число, длину волны, число электронвольт. Решение. 1. Частота света равна:
2. Волновое число
3.Длина волны l = 4. Число электронвольт
Пример 2. Пары ацетона под действием монохроматического света с длиной волны 313 нм разлагаются по уравнению
При проведении опыта в реакторе объемом 59 см3 при температуре 56,7 °С зафиксированы следующие данные: начальное давление Р 0=102,16 кПа; конечное давление Р =104,42 кПа; интенсивность направляемого светового потока I = 4,81·10-3 Дж·с-1; длительность облучения 7 ч; пары ацетона поглощают 91,5% ( Решение. 1. Рассчитаем количество молей вещества, образовавшегося в ходе фотохимической реакции:
Скорость образования продуктов равна:
3.Энергия одного кванта равна:
4. Интенсивность поглощенного ацетоном светового потока
5.Общий квантовый выход равен:
Вопросы и задания для самоконтроля. 1. Проанализируйте случаи, когда фотохимическая реакция имеет нулевой или первый порядок по концентрации поглощающего света вещества. 2. Что называют общим квантовым выходом Ф фотохимической реакции? Укажите интервал возможных значений Ф. 3. Дайте определение первичного квантового выхода 4. Какой процесс называют флуоресценцией? Для каких молекул она характерна? Каков интервал жизни для флуоресценции? 5. Какой процесс называют фосфоресценцией? Каков интервал жизни для фосфоресценции? 6. Какие процессы рассматривает механизм Штерна–Фольмера? Теории химической кинетики
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 885; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |

 , (4.188)
, (4.188) .
. , (4.189)
, (4.189) , который равен отношению числа действительно прореагировавших молекул к числу поглощенных квантов. Таким образом, скорость фотохимической реакции определяется по уравнению:
, который равен отношению числа действительно прореагировавших молекул к числу поглощенных квантов. Таким образом, скорость фотохимической реакции определяется по уравнению: . (4.190)
. (4.190) , (4.191)
, (4.191) - молярный коэффициент поглощения; с– концентрация вещества, поглощающего свет.
- молярный коэффициент поглощения; с– концентрация вещества, поглощающего свет. . (4.192)
. (4.192) . (4.193)
. (4.193) может меняться от 10-3 до 106. При
может меняться от 10-3 до 106. При  =3,16·1014 с-1.
=3,16·1014 с-1. = 10500с-1.
= 10500с-1. = 9,52·10-5 см = 952 нм.
= 9,52·10-5 см = 952 нм. =1,31 эВ.
=1,31 эВ. .
.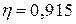 ) от интенсивности пропускаемого светового потока. Определите квантовый выход реакции.
) от интенсивности пропускаемого светового потока. Определите квантовый выход реакции. =4,86·10-5 моль.
=4,86·10-5 моль. = 3,27·10-8 моль/л·с.
= 3,27·10-8 моль/л·с. =6,36·10-19 Дж.
=6,36·10-19 Дж. = 1,95·10-7 моль/л·с.
= 1,95·10-7 моль/л·с. =0,168.
=0,168. . Может ли
. Может ли 


