
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Потенциалы электродов. Классификация электродов
При схематической записи электрохимических систем и уравнений, описывающих протекающие в них реакции, необходимо соблюдать следующие основные правила. 1. Для электродов (полуэлементов): вещества, находящиеся в растворе (можно только потенциалопределяющие ионы), указываются слева от вертикальной черты, справа указываются вещества, образующие другую фазу, или материал электрода. Состояния всех веществ указывается в скобках. Например, (р-р) – вещество находится в растворе (как правило - жидком), (г) — вещество находится в газовой фазе, (т) – вещество образует твердую фазу (как правило, обозначение состояния твердых фаз опускают). 2. Если в растворе находится несколько веществ, то они разделяются запятыми. Вещества, составляющие различные фазы разделяются с помощью вертикальной черты. Например: Cd2+(aq) | Cd(т); Cl–(aq) | AgCl(т) | Ag(т); H+(aq) | H2(г) | Pt(т) 3. Уравнение электродной реакции записывается так, чтобы слева располагались вещества в окисленной форме и электроны, а справа вещества в восстановленной форме: Cd2+(aq) + 2 e– AgCl(т) + e– 2 H+(aq) + 2 e– Принято выражать потенциалы электродов относительно стандартного водородного электрода (условная водородная шкала потенциалов), потенциал которого принят за ноль при всех температурах. Для определения электродного потенциала электрода составляется гальванический элемент из этого электрода и стандартного водородного электрода — H+(aq, a± = 1) | H2(г, p = 105 Па) | Pt (активность иона водорода поддерживается равной единице и парциальное давление водорода над раствором — 105 Па). Переход к условной шкале потенциалов позволяет избавиться от многих трудностей и неопределенностей при решении большинства электрохимических задач. Согласно правилам ИЮПАК условный электродный потенциал или просто электродный потенциал определяется как ЭДС элемента, в котором слева расположен стандартный водородный электрод, а справа — рассматриваемый электрод. Например, потенциал кадмиевого электрода (Cd2+(aq) | Cd) будет равен ЭДС элемента Pt | H2(г, p = 105 Па) | H+(aq, a ± = 1) || Cd2+(aq) | Cd. Потенциал рассматриваемого электрода обозначается при этом символом E. В справочниках приводятся условные стандартные потенциалы электродов при некоторой температуре, которые измерены относительно стандартного водородного электрода при соотношении активностей веществ, участвующих в электродной реакции, равном единице.
Тогда, для рассмотренного примера, потенциал кадмиевого электрода будет записан как
где Запись и порядок применения уравнения Нернста сохраняется при переходе к условной шкале потенциалов с заменой
В различных учебниках можно найти разные классификации электродов. Однако существует общепринятая классификация электродов, рекомендованная ИЮПАК (Международный союз теоретической и прикладной химии).
|
|||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 274; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.6.75 (0.004 с.) |
 Cd(т);
Cd(т); ,
, – стандартный электродный потенциал кадмиевого электрода.
– стандартный электродный потенциал кадмиевого электрода. и
и  на E и E°. Тогда уравнение Нернста для условной шкалы потенциалов запишется в виде:
на E и E°. Тогда уравнение Нернста для условной шкалы потенциалов запишется в виде: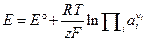 . (3. 17)
. (3. 17)


