
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молярная электрическая проводимость растворов электролитовСодержание книги
Поиск на нашем сайте
Молярная электрическая проводимость раствора l - мера электрической проводимости всех ионов, образующихся при диссоциации 1 моля электролита при данной концентрации. Она численно равна электрической проводимости такого объёма V (м3) раствора, который заключен между двумя параллельными электродами, с межэлектродным расстоянием 1м, причём каждый электрод имеет такую площадь, чтобы в этом объёме содержался 1 моль растворённого вещества. Между молярной и удельной электрическими проводимостями имеется соотношение l = æ V = æ с, (2.4) где l – молярная электрическая проводимость, См×м2моль; æ – удельная электрическая проводимость; См м; V – разведение раствора, м3 моль; с – концентрация раствора электролита, моль м3. Если концентрация раствора выражена в мольл, т.е. моль/дм3, то уравнение (2.4) записывается в виде:
Молярная электрическая проводимость прямо пропорциональна абсолютным скоростям движения ионов (u + , u -): l = a·F (u ++ u -). (2.6) Абсолютной скоростью движения иона называется его скорость при градиенте потенциала в 1 В/·м, её размерность [ иi ] = В·м2·с-1. Общий характер изменений молярной электрической проводимости с концентрацией для сильных и слабых электролитов выражен кривыми, представленными на рис.2.
С увеличением разведения, т.е. с уменьшением концентрации раствора, молярная электрическая проводимость возрастает и в области разведений стремится к предельному значению l¥ . Эта величина отвечает электрической проводимости гипотетического бесконечно разбавленного раствора, характеризующегося полной диссоциацией электролита (a=1) и отсутствием сил электростатического взаимодействия между ионами.
В соответствии с (2.6) молярная электрическая проводимость бесконечно разбавленного раствора будет выражаться уравнением:
Произведение
Предельная молярная электрическая проводимость является специфической величиной для данного вида ионов и зависит только от природы растворителя и температуры.
Величина молярной электрической проводимости бесконечно разбавленного раствора электролита представляет собой сумму двух независимых слагаемых, каждая из которых соответствует определённому виду ионов, т.е. сумму подвижностей ионов при предельном разбавлении. Это соотношение установлено Кольраушем и называется законом независимого движения ионов. Величина молярной электрической проводимости определяется по подвижностям ионов, которые приведены в справочнике. Подвижности большинства ионов примерно одинаковы, кроме ионов H3O+ и OH-, которые обладают очень высокими абсолютными скоростями. Причиной этого явления является эстафетный механизм перемещения этих ионов в растворе от одной молекулы растворителя к другой. Кондуктометрия Кондуктометрия основана на измерении электрической проводимости растворов электролитов. В электрохимической промышленности электрохимическая проводимость играет большую роль при составлении энергетических и тепловых балансов электролизеров и химических источников тока, а так же в мембранной технологии. Экспериментальной величиной в методе кондуктометрии является сопротивление раствора электролита. Для измерения сопротивления применяется мостовая схема Уинстона. Принцип измерения электрической проводимости растворов электролитов приведен на рис.3.
В основе этой схемы лежит метод компенсации. Во избежание электролиза, влекущего за собой изменение концентрации электролита и поляризацию электродов, при компенсационном способе измерения сопротивления используется переменный ток высокой частоты. Форма и расположение электродов во всех измерениях должны быть постоянным. По экспериментально определенному сопротивлению исследуемого раствора рассчитывают значения удельной и молярной электрической проводимости электролитов. Метод кондуктометрии используется для определения ряда физико-химических характеристик растворов электролитов. 1. Степень диссоциации слабых электролитов рассчитывается по уравнению
где 2. Константу диссоциации бинарного электролита можно рассчитать по уравнению (1.3):
3. По данным кондуктометрии можно рассчитать pH раствора, образованного растворением электролита, при диссоциации которого образуются ионы водорода. Так, для бинарного электролита pH = -lg aС. (2.11) 4. По данным кондуктометрии можно рассчитать растворимость (С) и произведение растворимости (Lр) малорастворимой соли:
Примеры решения задач Пример 1. Водный раствор, содержащий массовую долю CaCl2, равную 5 %, имеет при температуре 298 К плотность ρ = 1.039 г/см3 и удельную электрическую проводимость 6.43·10-2 См/см. Определите молярную электрическую проводимость. Решение. Пересчитаем массовую долю CaCl2 на молярную концентрацию:
Молярную электрическую проводимость определим по формуле:
Пример 2. В ячейку для измерения электрической проводимости, заполненную 0.06 М раствором СН3СООН, помещены параллельные электроды площадью 3 см2 на расстоянии 2 см друг от друга. При напряжении 10 В через раствор при температуре 298 К идет ток 4.306·10-3 А. Пренебрегая особенностями конструкции ячейки, определите степень диссоциации, константу диссоциации и рН раствора, если при указанной температуре подвижность ионов Н+ и СНзСОО– соответственно равна λ∞H+ = 349.8; равна λ∞CH3COO – = 40.90 См·см 2/моль. Решение. Степень диссоциации уксусной кислоты α = λ / λ∞.Используя параметры ячейки, найдем удельное сопротивление раствора по формуле:
а затем и удельную электрическую проводимость: æ = Молярную электрическую проводимость определим по формуле:
Тогда степень диссоциации
Константа диссоциации равна
Концентрация ионов водорода зависит от степени диссоциации: CH+ = ас; с = 0,0123·0,06 = 7,38·10–4 моль/дм3. И наконец, рН раствора: рН = –lg СH+ = –lg (7,38·10–4)= 3,13.
Вопросы для самоконтроля 1. Что такое «степень диссоциации электролита»? Какие из указанных параметров влияют на степень диссоциации электролита: температура, концентрация, вязкость раствора, радиус иона, константа диссоциации электролита? 2. Что такое «константа диссоциации электролита»? Какие из указанных параметров влияют на значение константы диссоциации электролита: степень диссоциации электролита, температура, концентрация электролита. 3. Объясните смысл терминов удельная и молярная электрические проводимости. В каких единицах они измеряются? 4. Какие переменные и как определяются экспериментально в методе кондуктометрии? Какие физико-химические константы можно рассчитать по данным электропроводимости? 5. Для каких электролитов справедливо уравнение:
6. Чем определяется электропроводность растворов электролитов? 7. Как и почему изменяется электропроводность растворов слабых электролитов при изменении концентрации? 8. Как влияет изменение концентрации на электропроводность растворов сильных электролитов? Электролиз. Числа переноса Взаимное превращение электрической и химической форм энергии происходит в электрохимических системах. Основными элементами такой системы являются: металлические или полупроводниковые электроды (проводники первого рода) и проводники второго рода (раствор электролита, его расплав или твердый электролит).
По направлению процесса взаимного превращения электрической и химической форм энергии различают две группы электрохимических систем: электролизеры и химические источники тока. Электрохимическая система, работающая за счет внешнего источника тока, называется электролизером. В электролизерах при электролизеза счёт внешней электрической энергии в системе происходят электрохимические превращения. На границе электрод – раствор происходит передача электронов от электрода к ионам или от ионов к электроду. При электролизе на катоде происходит процесс восстановления (электрод отдаёт электроны, полученные от внешнего источника тока) по реакции а на аноде идет процесс окисления по реакции Освобождающиеся при окислении электроны поступают во внешнюю цепь. Химические превращения при электролизе могут быть самыми различными, в зависимости от природы электролита и растворителя, а также от материала электрода и присутствия других веществ в растворе. Количественными характеристиками процесса электролиза являются – масса полученных веществ, плотность тока, выход по току, напряжение электролиза и другие. Масса вещества, разложившегося или образовавшегося при электролизе, прямо пропорциональна количеству пропущенного электричества этого: где Из законов Фарадея следует, что при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны их молярным массам. Отсюда где - М – молярная масса вещества (г/моль),, Число Фарадея является одной из основных постоянных современной физики. При пропускании через электролитическую ячейку одного фарадея электричества на аноде или на катоде в электрохимическую реакцию вступает моль/z количества вещества. Это следует из простого факта – заряд одного моля однозарядных ионов (N = 6,022 1023 ионов) составляет Плотность тока
Законы Фарадея являются общими и точными законами электрохимии. Однако при электрохимических процессах часто наблюдаются отклонения от этих законов: масса m ддействительно полученного или разложившегося продукта не соответствует теоретической mТ. Эти отклонения – кажущиеся и возникают за счёт одновременного протекания побочных электрохимических или химических процессов. Эффективность основного электрохимического процесса оценивается выходом по току:
Для измерения количества прошедшего электричества используются электролизеры, в которых нет параллельных электрохимических и побочных химических реакций. Они называются кулонометрами. По методам определения количества образующихся веществ кулонометры делятся на весовые, объемные, титрационные и др. Например, действие серебряного кулонометра, представляющего собой электролизер (-) Ag ½AgNO3 ½ Ag (+), основано на взвешивании массы серебра, осевшей на катоде во время электролиза по реакции: Ag+ + e = Ag0 . При пропускании одного Фарадея электричества на катоде выделяется один моль-экв. cеребра, равный 107 г. В объемных кулонометрах определяют изменение объемов газообразных веществ, являющихся продуктами электролиза. В титрационных кулонометрах методом титрования определяют количества вещества, образовавшегося при электролизе. Плотность тока Процессы электролиза в принципе обратны процессам, протекающим на электродах при работе гальванического элемента. При электролизе сила тока, а, следовательно, и количество вещества, прореагировавшего на электродах, зависит от разности потенциалов (напряжения) на электродах. При повышении напряжения сила тока увеличивается, а при снижении, наоборот, - уменьшается. Для того, чтобы процесс электролиза протекал со значимым выходом, разность потенциалов, приложенная к электродам, должна быть не меньше некоторой определенной для данного процесса величиной. Минимальная разность потенциалов, которую необходимо создать между электродами для того, чтобы на электродах пошел процесс электролиза с образованием электродных продуктов называется напряжением разложения. Напряжение разложения не может быть меньше, чем ЭДС гальванического элемента, в котором протекает суммарная реакция противоположного направления, чем при электролизе в электролизере. В общем случае напряжение разложения складывается из разности электродных потенциалов анода и катода при плотности тока электролиза и падения напряжения в растворе электролита
где При работе электролизера происходит отклонение потенциалов электродов от равновесных значений (при отклонении потенциала электрода от равновесного через электрод протекает ток). Это явление называется поляризацией, а разность между потенциалом электрода и его равновесным значением называется перенапряжением на электродах. Перенапряжение принято считать положительной величиной. Поэтому анодное
Термин перенапряжение применяется к отдельным электродным процессам и к данному процессу электролиза в целом. Перенапряжение электролиза равно сумме перенапряжений на электродах. В водных растворах процесс электролиза осложняется возможной реакцией разложения воды: а на аноде Потенциал восстановления ионов водорода в нейтральной среде равен -0,41 В, поэтому металлы с электродным потенциалом более положительным, чем эта величина (расположенные в ряду напряжений правее железа) восстанавливаются на катоде. Если электродный потенциал металла значительно отрицательнее, чем – 0,41 В, то металл не восстанавливается, а происходит восстановление воды и выделение водорода. Если электродный потенциал металла отрицательнее, но отличается от -0,41 В незначительно ( Стандартный потенциал окисления воды равен 1,23 В. У простых анионов ( Если анод изготовлен из металлов, электродные потенциалы которых ниже чем потенциал окисления анионов соли, то происходит окисление анода. Например, электролиз раствора В этом случае новых веществ не образуется, а происходит перенос свинца с анода на катод. Если в качестве анода использовать инертный электрод, например, графитовый, то на электродах будут протекать следующие реакции:
Скорости движения различных ионов в растворах электролитов отличаются друг от друга. Поэтому они при движении переносят разное количество электричества. Для оценки количества электричества, переносимого разными ионами введено понятие – число переноса. Числом переноса ионов называется доля количества электричества, переносимая данным видом ионов.
где t + и t – – число переноса катиона и аниона. К методам определения чисел переноса относят метод Гитторфа, основанный на определении изменения концентрации электролита в результате электролиза в катодном или анодном отделении электролизера и сопоставлении полученных результатов с данными материального баланса процесса электролиза. Например, при пропускании через раствор соляной кислоты 1 фарадея (F = 96500 к) электричества в электролизере с платиновыми электродами (пространство между электродами разделено пористыми перегородками) будут протекать следующие электрохимические реакции: на катоде на аноде При этом через раствор от анода к катоду пройдет t + моль катионов и от катода к аноду - t – моль анионов. Катионы перенесут t + фарадеев электричества, а анионы - t – фарадеев. В сумме катионы и анионы перенесут t + + t – = 1 фарадей электричества. В катодном отделении, в результате протекания реакции из раствора выделится 1 моль ионов водорода, а в анодном отделении из раствора выделится 1 моль анионов хлора. Материальный баланс катодного и анодного пространств тогда можно представить в следующем виде: катодное пространство: анодное пространство: Из материального баланса следует, что при пропускании через раствор одного фарадея электричества в катодном пространстве содержание Если при пропускании через электролизер (q – количество электричества в кулонах) содержание Числа переноса можно также определить, используя метод движущейся границы. Этот метод основан на измерении скорости движения ионов, которая определяется по скорости перемещения границы между двумя растворами при прохождении тока. В вертикальной трубке имеются два слоя растворов электролитов СА и МА, образующих четкую границу, которая при прохождении тока перемещается со скоростью, равной скорости движения ионов. Числа переноса находят следующим образом. При прохождении через систему одного фарадея электричества (1 F = 96500 кулонов) через каждый 1 см2 сечения трубки должно пройти в направлении к катоду число моль-эквивалентов катионов, равное числу переноса tк. Если площадь поперечного сечения трубки равно s см2, а расстояние, пройденное границей за время пропускания q Кл, равно l см, то число переноса катиона равно Так как q в Кл можно рассчитать, зная ток (в А) и время (в секундах) пропускания тока, то число переноса может быть вычислено по перемещению границы за время опыта. Метод движущейся границы часто используется измерений чисел переноса вследствие его сравнительной простоты и точности получаемых результатов.
Примеры решения задач Пример 1. Металлический предмет поверхностью 100 см2 требуется покрыть никелем слоем в 0,3 мм. Плотность никеля 9,0 г/см3. Сколько времени требуется пропускать ток силой 3 А, если 10% тока теряется в аппарате? Решение. 1. Определим массу никеля, необходимую для покрытия:
2. По закону Фарадея найдем необходимое количество электричества:
3. При силе тока в 3 А потребуется время электролиза:
4. Учтем 10% возможных потерь: t ¢ = Пример 2. Раствор, содержащий 1,139·10–3 г ионов серебра в 1 см3, подвергался электролизу между серебряными электродами. После электролиза методом титрования пробы было установлено, что 20,09 см3 анодной жидкости содержит 0,03966 г ионов серебра. За время электролиза в присоединенном последовательно кулонометре отложилось 0,0321 г серебра. Найдите числа переноса ионов Ag+ и NO3–. Изменится ли концентрация раствора в среднем пространстве? Решение. Составим материальный баланс изменения концентрации для анодного пространства при прохождении через раствор 96 500 Кл (1 F) электричества: (–) Ag| AgNO3(aq) | AgNO3(aq) | AgNO3(aq)|Ag (+) катод катодное среднее анодное анод пространство пространство пространство В данном случае анод растворяется за счет электрохимической реакции Ag →Ag+ + е – В анодное пространство из среднего диффундируют ионы NO3– и переносят молярную массу эквивалента t – (г/моль). В среднее пространство диффундируют из анодного пространства ионы серебра и уносят молярную массу эквивалента t+ (г/моль). Материальный баланс для анодного пространства раствора +l Ag+ – t+ Ag + + t –NO3 = + t – AgNO3. Из уравнения следует, что при пропускании одного Фарадея электричества, содержание азотнокислого серебра в анодном пространстве увеличится на t - молей. Изменение молярной массы эквивалентов ионов серебра в анодном пространстве составит
Общее количество электричества пропущенного через раствор пропорционально количеству серебра, выделенного в серебряном кулонометре за время электролиза
Тогда можно составить пропорцию, из которой можно определить число переноса аниона. При пропускании одного Фарадея (96500 к) электричества, содержание азотнокислого серебра в анодном пространстве увеличится на t - молей, а при пропускании q = 28,95 к электричества, содержание азотнокислого серебра в анодном пространстве увеличилось на 1,566 10-4 молей. Отсюда:
Число переноса катиона Ag+ находим по разности t + = 1 – t – = 1 – 0,522 = 0,478. Материальный баланс для среднего пространства показывает, что концентрация раствора в среднем пространстве за время электролиза не изменится: – t + Ag+ + t – NO3– + t+ Ag+ – t – NO3– = 0. Пример 3. После электролиза раствора CdCl2 (с массовой долей хлорид-ионов 0,2020%) с растворимым кадмиевым анодом и платиновым катодом, 33,59 г раствора анодного пространства содержало ионы хлора, масса которых равна 0,0802 г. В серебряном кулонометре за это время выделилось серебро массой 0,0666 г. Найдите числа переноса Сd2+ и Cl–. Решение. Рассчитаем, чему равно изменение массы хлорид-ионов для анодного пространства при пропускании 1 F электричества. (–)Pt |CdCl2(aq) | CdCl2(aq) | CdCl2(aq) |Cd (+) катод катодное среднее анодное анод пространство пространство пространство
Электрохимическая реакция на аноде Cd → Cd 2+ + 2 е– Молярная масса эквивалента ионов в анодном пространстве изменится за счет: растворения анода на +1(½Сd2+) ухода в среднее пространство катионов на – t +(½ Сd2+) прихода из среднего пространства анионов на + t – (Cl-) Материальный баланс для анодного пространства раствора +1(½ Сd2+) – t +(½ Сd2+) + t – (Сl-) = + t – (½ СdCl2) г/моль. Масса хлорид-ионов до электролиза в 33,59 г анодной жидкости равна
Изменение молярной массы хлорид-ионов в анодном пространстве составит
Число пропущенных фарадеев электричества равно
Число переноса хлорид-ионов находим по соотношению:
Число переноса катиона Cd2+ находим по разности t + = 1 – t – = 1 – 0,563 = 0,437.
Вопросы для самоконтроля 1. Сколько и каких продуктов можно получить в результате пропускания тока силой 10 А через электролизер в течение часа, если электролизер заполнен: а) расплавом иодида серебра; б) разбавленным водным раствором иодида серебра. 2.Для калибровки шкалы амперметра, имеющей100 делений, использовали газовый кулонометр, включенный последовательно с амперметром. Силу тока в цепи установили равной 50 делениям амперметра. За 100 с электролиза в кулонометре выделилось 9,47 см3 смеси газов (объем замерен при температуре 20°С и давлении 9,87.105 Па). Чему равна цена деления амперметра? 3. Число переноса для иона цинка в растворе ZnCl2 равно 0,4. Через раствор хлористого цинка пропускается ток 0,167 А в течение 50 минут. Электроды платиновые. Найдите убыль концентрации ZnCl2 в граммах в катодном и анодном слоях раствора. 4. Составьте схему процессов, протекающих на катоде и на аноде при электролизе раствора CuSO4, если оба электрода: а) платиновые; б) медные. 5. Ток, силой 0,2 А пропускается 300 с через раствор H2SO4. Каков объем выделившихся Н2 и О2 при 300 К и давлении 1,013.105 Па, если выход по току составляет 80 %? 6. По какому уравнению и как можно рассчитать
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 846; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.204.147 (0.016 с.) |

 æ. (2.5)
æ. (2.5) Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации.
Рис.2. Зависимость молярной электрической проводимости растворов сильных (1) и слабых (2) электролитов от их концентрации.
 (2.7)
(2.7) называется предельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде:
называется предельной молярной электрической проводимостью иона или подвижностью иона. Уравнение (2.7) можно записать в виде: . (2.8)
. (2.8) Рис. 3 Схема установки для измерения электрического сопротивления раствора электролита.
RМ и Rx – сопротивления магазина и ячейки; Г - источник переменного тока; О – осциллограф.
Рис. 3 Схема установки для измерения электрического сопротивления раствора электролита.
RМ и Rx – сопротивления магазина и ячейки; Г - источник переменного тока; О – осциллограф.
 , (2.9)
, (2.9)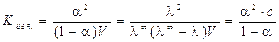 . (2.10)
. (2.10) и
и  . (2.12)
. (2.12) .
.

 ; æ =
; æ =  = 2.87·10–4 См/см.
= 2.87·10–4 См/см. См·см2/моль.
См·см2/моль. = 0.0123.
= 0.0123. = 9.19·10–6 моль/дм3.
= 9.19·10–6 моль/дм3. .
. ,
, .
. , (2.13)
, (2.13) - количество электричества (Кл),
- количество электричества (Кл),  - количество вещества, участвующего в электродной реакции (моль),
- количество вещества, участвующего в электродной реакции (моль),  - число Фарадея (96500 Кл/моль-экв = 26,8 А ч/моль-экв),
- число Фарадея (96500 Кл/моль-экв = 26,8 А ч/моль-экв),  - число электронов, участвующих в электродной реакции.
- число электронов, участвующих в электродной реакции. , (2.14)
, (2.14) - сила тока (А),
- сила тока (А),  - продолжительность электролиза (с).
- продолжительность электролиза (с). кулонов, где
кулонов, где  - заряд иона в кулонах. Следовательно, для окисления или восстановления одного моля однозарядных ионов необходим один фарадей электричества, для двух зарядных ионов – два фарадея и т. д.
- заряд иона в кулонах. Следовательно, для окисления или восстановления одного моля однозарядных ионов необходим один фарадей электричества, для двух зарядных ионов – два фарадея и т. д. (А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
(А/м2) - это отношение силы тока к величине рабочей поверхности электрода. Плотность тока определяет скорость электродного процесса. Чем выше плотность тока, тем больше скорость процесса и производительность электролизера.
 (2.15)
(2.15) .
. ,
, - напряжение разложения,
- напряжение разложения, 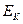 и
и  - потенциалы катода и анода.
- потенциалы катода и анода. и катодное
и катодное  перенапряжения определяются следующими выражениями
перенапряжения определяются следующими выражениями ;
;  .
. . На катоде могут протекать следующие реакции
. На катоде могут протекать следующие реакции (нейтральная или щелочная среда),
(нейтральная или щелочная среда), (кислая среда),
(кислая среда), (кислая или нейтральная среда),
(кислая или нейтральная среда), (щелочная среда).
(щелочная среда). ), то возможно восстановления металла и воды. Восстановление таких металлов возможно потому, что для восстановления водорода требуется значительное перенапряжение. Например, перенапряжение водорода на ртутном электроде составляет - 0,57 В.
), то возможно восстановления металла и воды. Восстановление таких металлов возможно потому, что для восстановления водорода требуется значительное перенапряжение. Например, перенапряжение водорода на ртутном электроде составляет - 0,57 В. ) потенциал окисления меньше чем 1,23 В, поэтому на аноде происходит образование соответствующих простых веществ. Если в растворе находятся анионы, потенциал окисления которых выше, то на аноде идет окисление воды.
) потенциал окисления меньше чем 1,23 В, поэтому на аноде происходит образование соответствующих простых веществ. Если в растворе находятся анионы, потенциал окисления которых выше, то на аноде идет окисление воды.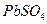 с использованием свинцового анода идет по следующей схеме:
с использованием свинцового анода идет по следующей схеме:
 .
.
 ; (2.16)
; (2.16) , (2.17)
, (2.17) ;
;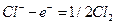 .
. ;
; .
. уменьшится на t – молей, а в анодном пространстве содержание
уменьшится на t – молей, а в анодном пространстве содержание  фарадеев электричества
фарадеев электричества молей, а в анодном пространстве на
молей, а в анодном пространстве на  , то числа переноса можно определить из следующих соотношений:
, то числа переноса можно определить из следующих соотношений: ;
;  . (2.18)
. (2.18) . (2.19)
. (2.19)
 г.
г. Кл.
Кл.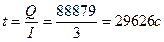 .
. 9 ч 8 мин.
9 ч 8 мин. моль.
моль. кулонов
кулонов

 г.
г.
 = 0,563.
= 0,563. ? Рассчитайте
? Рассчитайте 


