
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Решение кинетических задач для гетерогенно-каталитических процессовСодержание книги
Поиск на нашем сайте Пусть на поверхности твердого катализатора протекает химическая реакция первого порядка. Все участники реакции - газы. В ® gG + rR. Реакция осуществляется в реакторе закрытого типа (V = const.). Случай 1. На поверхности катализатора наблюдается слабая адсорбция только вещества В. Для решения кинетической задачи запишем два уравнения: а) скорость реакции на основе обычных представлений о скорости
б) скорость реакции на основе закона действующих поверхностей равна:
Если
Тогда:
Так как реакция протекает в газовой фазе, продукты реакции не адсорбируются, поэтому степень заполнения поверхности катализатора реагентом можно выразить через уравнение Лэнгмюра:
Объединяя (5.79) и (5.80) получим:
Так как адсорбция вещества В- слабая, то b∙рB <<1, поэтому:
В уравнении (5.82) три переменные величины - t, x и р B . Так как вся реакция протекает в газовой фазе, то число молей компонента В связано с парциальным давлением этого компонента уравнением Менделеева- Клапейрона:
где V - объем реактора. Из уравнения (5.83) можно найти производную
Уравнение (5.84) подставим в уравнение (5.82), разделим переменные и проинтегрируем полученное уравнение:
В результате интегрирования получим:
Из этого уравнения можно вычислить константу скорости гетерогенной каталитической химической реакции первого порядка в случае слабой адсорбции исходного вещества:
Если параметры реактора остаются постоянными, то уравнение принимает вид обычного уравнения для реакции первого порядка с константой скорости каталитического процесса равной:
Случай 2. Вещество В адсорбируется умеренно (0< b >1), продукты реакции не адсорбируются. В этом случае справедливо уравнение (5.81). Подставим в это уравнение соотношение (5.84):
Разделим переменные и проинтегрируем уравнение (5.89):
После интегрирование получим уравнение:
Из этого уравнения можно вычислить константу скорости гетерогенной каталитической химической реакции первого порядка в случае средней адсорбции исходного вещества:
Случай 3. Вещество В адсорбируется слабо, вещество G - сильно, вещество R – не адсорбируется. Степень заполнения поверхности катализатора реагентом можно выразить через уравнение, куда войдут характеристики адсорбции исходного вещества и одного из продуктов реакции:
Учтем, что адсорбция В слабая, а адсорбция G - сильная, тогда:
Подставим (5.94) в (5.79) и учтем, что
Тогда:
Разделим переменные и проинтегрируем полученное уравнение:
После интегрирования, получим уравнение:
Константа скорости данной реакции будет равна:
Примеры решения задач Пример1. Исследовалась кинетика процесса разложения N2O на золотом катализаторе при 900 °С. Получены следующие данные:
Известно, что N2O слабо сорбируется на Au, а продукты разложения не сорбируются совсем. Нужно рассчитать константу скорости данного процесса. Решение. Скорость процесса зависит от степени заполнения катализатора сорбентом:
Для слабой адсорбции исходного вещества (b << 1 по условию) скорость процесса будет пропорциональна
То есть данная каталитическая реакция является реакцией первого порядка, для которой константа скорости равна:
Пример 2. Исследовалась кинетика процесса разложения SbH3 на катализаторе из Sb при 25 °С. Давление SbH3 в реакторе менялось во времени следующим образом:
Считая, что SbH3 сорбируется на катализаторе умеренно (b =1,824·10-5 м2/Н), а продукты разложения не сорбируются совсем, рассчитать константу скорости данного процесса. Решение. Скорость процесса зависит от степени заполнения катализатора сорбентом:
Для средней адсорбции исходного вещества константа скорости процесса может быть рассчитана по уравнению:
Подсчитаем значения констант в различные моменты времени протекания реакции.
k ср =0,162·мин-1.
|
||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |

 ; (5.76)
; (5.76) . (5.77)
. (5.77) – исходное количество молей вещества В, участвующее в реакции, а (
– исходное количество молей вещества В, участвующее в реакции, а ( ) – количество молей вещества В к моменту времени t, то:
) – количество молей вещества В к моменту времени t, то: . (5.78)
. (5.78) . (5.79)
. (5.79)
 . (5.80)
. (5.80) . (5.81)
. (5.81) . (5.82)
. (5.82) , (5.83)
, (5.83)
 :
: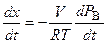 . (5.84)
. (5.84) . (5.85)
. (5.85) . (6.86)
. (6.86) . (5.87)
. (5.87)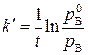 . (5.88)
. (5.88) . (5.89)
. (5.89) . (5.90)
. (5.90) . (5.91)
. (5.91) . (5.92)
. (5.92) . (5.93)
. (5.93) . (5.94)
. (5.94) . (5.95)
. (5.95) . (5.96)
. (5.96) . (5.97)
. (5.97) . (5.98)
. (5.98) . (5.99)
. (5.99) ·10–5, Н/м2
·10–5, Н/м2
 где b – адсорбционная константа Лэнгмюра.
где b – адсорбционная константа Лэнгмюра. :
: , где k = k ’· b.
, где k = k ’· b.
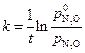 . Подсчитаем значения констант в различные моменты времени протекания реакции.
. Подсчитаем значения констант в различные моменты времени протекания реакции. =2,16·10-4с-1;
=2,16·10-4с-1;  =2,20·10-4с-1;
=2,20·10-4с-1;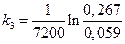 =2,10·10-4 с-1; k ср =2,15·10-4 с-1.
=2,10·10-4 с-1; k ср =2,15·10-4 с-1. 10–2,Н/м2·
10–2,Н/м2·
 где b – адсорбционная константа Лэнгмюра.
где b – адсорбционная константа Лэнгмюра. , где
, где  .
. =0,157 мин-1;
=0,157 мин-1;  =0,169 мин-1;
=0,169 мин-1;  =0,160 мин-1;
=0,160 мин-1; =0,167 мин-1;
=0,167 мин-1;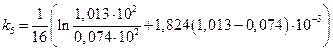 =0,156 мин-1.
=0,156 мин-1.


