
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кинетика химических реакций в реакторе идеального смешенияСодержание книги
Поиск на нашем сайте Уравнения, описывающие зависимость концентрации компонентов в реакторе идеального смешения существенно сложнее, чем в закрытой системе. Как уже отмечалось, в открытых системах производная от концентрации по времени не является скоростью реакции. Кроме того, уравнение материального баланса не может быть непосредственно выведено из стехиометрического уравнения. Приведем вывод некоторых основных соотношений, описывающих протекание реакций простых типов в реакторе идеального смешения. Пусть в реактор, объем которого В результате интенсивного перемешивания концентрация в любой точке реактора одинакова и не меняется во времени. При входе в реактор концентрация вещества уменьшается скачком. Концентрация реакционной смеси выходящей из реактора такая же, как в любой точке реакционного пространства. Количество i -го вещества, которое вводится в реактор, в единицу времени с конвективным потоком будет равно
Если скорость химической реакции определяется по исходному веществу, то ставится знак (-), а если по продукту реакции – то ставится знак (+). Скорость химической реакции должна определяться при условиях соответствующих условиям на выходе из реактора. Полученное уравнение описывает зависимость концентрации реагентов в реакторе идеального смешения для реакций любых порядков. Рассмотрим кинетику реакций в реакторе идеального смешения на примере реакции первого порядка
Для данной реакции запишем уравнение материального баланса по веществу А. Так как для реакции первого порядка
или
Разделив переменные, получим:
Интегрирование этого уравнения в пределах от 0до t и от
Уравнение зависимости концентрации вещества В от времени протекания реакции можно вывести из уравнения материального баланса по веществу В. Если в поступающем в реактор растворе отсутствует вещество В, то есть
Решив это дифференциальное уравнение, получим:
Это уравнение можно получить так же из соотношения: Из уравнений (4.135) и (4.137) следует, что при
Установление стационарного режима является важнейшей особенностью процессов, протекающих в открытых системах при постоянной скорости массопереноса. Нахождение стационарных концентраций может быть выполнено без интегрирования уравнений, путем приравнивания нулю производной от концентраций компонентов реакционной смеси от времени. То есть:
Используя это уравнение легко получить выражения для стационарных концентраций компонентов для реакций любых порядков. Следует отметить, что время достижения состояния, близкого к стационарному, может оказаться весьма малым. Близким к стационарному можно считать состояние, когда отклонение текущей концентрации от стационарной не превышает 5%. Тогда, например Степень превращения компонентов зависит от скорости химической реакции и от времени пребывания реакционной смеси в реакторе. Среднее время пребывания реакционной смеси в реакторе определяется объемом реактора и объемной скоростью подачи реагентов в реактор:
Отсюда, для реакции первого порядка (
Для решения практических задач удобно концентрации реагентов выражать через степень превращения вещества ( Тогда, для реакции первого порядка:
Для реакции второго порядка (
для параллельной реакции (
Эти уравнения позволяют, при заданных объеме и производительности по исходному веществу, определить концентрацию реагентов на выходе из реактора или среднее время пребывания Часто скорость сложных химических реакций выражается в виде кинетических уравнений дробного порядка. В этом случае аналитическое решение оказывается невозможным и приходится прибегать к численным или графическим методам решения.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 381; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.008 с.) |

 , вводится реакционная смесь с объемной скоростью
, вводится реакционная смесь с объемной скоростью  Одновременно, из реактора выводится реакционная смесь с той же объемной скоростью. При этом объем реакционного пространства будет оставаться постоянным.
Одновременно, из реактора выводится реакционная смесь с той же объемной скоростью. При этом объем реакционного пространства будет оставаться постоянным. (кмоль/с). За это же время из реактора с конвективным потоком выводится количество i -го вещества равное
(кмоль/с). За это же время из реактора с конвективным потоком выводится количество i -го вещества равное  . Расход (образование) i -го вещества в ходе химической реакции составит
. Расход (образование) i -го вещества в ходе химической реакции составит  (кмоль/с). Тогда
(кмоль/с). Тогда . (4.132)
. (4.132)
 , то уравнение материального баланса будет иметь вид
, то уравнение материального баланса будет иметь вид ,
, . (4.133)
. (4.133) . (4.134)
. (4.134) до
до  дает:
дает: . (4.135)
. (4.135)
 , уравнение материального баланса запишется:
, уравнение материального баланса запишется: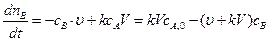 . (4.136)
. (4.136) . (4.137)
. (4.137) .
. концентрации А и В достигают предельных постоянных значений. Это означает, что сумма скоростей расходования вещества А за счет химической реакции и за счет ухода из реактора вместе с реакционной смесью становится равной скорости его поступления в реактор. Для вещества В установление постоянной концентрации означает, что скорость его накопления в результате образования из вещества А становится равной скорости его ухода из реактора. Такой режим процесса называется стационарным режимом, а концентрации А и В, соответствующие этому режиму, называются стационарными:
концентрации А и В достигают предельных постоянных значений. Это означает, что сумма скоростей расходования вещества А за счет химической реакции и за счет ухода из реактора вместе с реакционной смесью становится равной скорости его поступления в реактор. Для вещества В установление постоянной концентрации означает, что скорость его накопления в результате образования из вещества А становится равной скорости его ухода из реактора. Такой режим процесса называется стационарным режимом, а концентрации А и В, соответствующие этому режиму, называются стационарными: 
 ;
;  . (4.138)
. (4.138) . (4.139)
. (4.139) . При
. При 
 ,
, 
 и
и 
 время достижения стационарного состояния будет равно 5,87 с.
время достижения стационарного состояния будет равно 5,87 с. . Как правило,
. Как правило,  и
и  варьируются таким образом, чтобы среднее время пребывания реакционной смеси в реакторе было больше или равно (с определенным приближением) времени наступления стационарного режима. Тогда
варьируются таким образом, чтобы среднее время пребывания реакционной смеси в реакторе было больше или равно (с определенным приближением) времени наступления стационарного режима. Тогда . (4.140)
. (4.140) ) эти величина равны:
) эти величина равны: ;
;  ;
;  . (4.141)
. (4.141)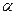 ). Так как
). Так как 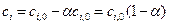 , то
, то  .
. a
a  (4.142)
(4.142) ):
): , (4.143)
, (4.143) ):
): . (4.144)
. (4.144) и, затем, размеры реакционного пространства
и, затем, размеры реакционного пространства  при заданной степени химического превращения.
при заданной степени химического превращения.


