
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электроды нулевого рода (окислительно-восстановительные электроды)Содержание книги
Поиск на нашем сайте Окислитель и восстановитель, как правило, находятся в растворе, а фаза проводника первого рода выполнена из инертного материала (например, Pt), которая выступает в качестве контакта и не участвует в электрохимической реакции. Ox(р-р), Red(р-р) | Pt Ox(р-р) + z e– Рассмотрим несколько примеров. Окислительно-восстановительный электрод может состоять из простой окислительно-восстановительной пары. Например, Fe2+(aq), Fe3+(aq) | Pt. В таком электроде протекает реакция простой перезарядки иона Fe3+(aq) + e– Тогда потенциал этого электрода
В более сложном случае в окислительно-восстановительной реакции могут принимать участие вещества или ионы не изменяющие в ходе реакции своей степени окисления. Например, хингидронный электрод C6H4O2, C6H4(OH)2, H+(aq) | Pt. На электроде протекает реакция: C6H4O2 + 2H+(aq) + 2 e– Потенциал этого электрода
Потенциал электрода будет зависеть не только от концентрации хинона (Х) и гидрохинона (Г) в растворе, но и от активности иона водорода, т.е. кислотности среды. Такие электроды могут применяться для измерения pH раствора. Электроды первого рода Электродом первого рода называется система, состоящая из: 1. металла, погруженного в раствор, содержащий ионы этого металла 2. неметалла, погруженного в раствор, содержащий ионы этого неметалла Например, медный электрод представляет собой медную пластинку, погруженную в раствор, содержащий ионы меди: Cu2+(aq) | Cu. На медном электроде протекает реакция Cu2+(aq) + 2 e– Потенциал этого электрода определяется выражением
Этот электрод обратим относительно катиона, т.е. его потенциал является функцией активности катиона. В качестве примера неметаллического электрода можно привести селеновый электрод: Se2–(aq) | Se. На селеновом электроде протекает реакция Se + 2 e– Потенциал этого электрода определяется выражением
Этот электрод обратим относительно аниона – его потенциал является функцией активности аниона. Металлическая фаза может представлять собой не только чистое вещество, но быть сплавом (т.е. раствором). Например, амальгамные электроды Mz+(р-р) | M(р-р в Hg). Амальгамные электроды состоят из амальгамы металла (амальгама — раствор металла в ртути), погруженной в раствор, содержащий катионы этого металла. Mz+(р-р) + z e– и
где aM(Hg) — активность металла в амальгаме. В отличие от металлических электродов, потенциал амальгамного электрода зависит не только от концентрации иона металла в растворе, но и от концентрации металла в амальгаме. Электроды второго рода Электродом первого рода называется металл (A), погруженный в раствор, содержащий насыщенное соединение (малорастворимое или комплексное) иона этого металла (A+) и избытка аниона (B–). Таким образом, электрод второго рода обратим относительно аниона (т. е. его потенциал зависит от концентрации этого аниона). B–(р-р) | AB(т) | A(т) AB(т) + e–
Примеры, Cl–(aq) | AgCl | Ag — хлоридсеребряный электрод; Cl–(aq) | Hg2Cl2 | Hg — каломельный электрод. Примером может служить хлоридсеребряный электрод, состоящий из серебряной проволоки или пластины, покрытой осадком хлорида серебра, и опущенный в раствор, насыщенный относительно хлорида серебра и содержащий избыток хлорид-иона. Для этого часто используют соли хорошо растворимых хлоридов (KCl, NaCl). На электроде протекает окислительно-восстановительная реакция AgCl(т) + e– По уравнению Нернста, потенциал электрода равен:
Деление на электроды первого и второго рода, строго говоря, является условным. Любой электрод второго рода можно рассматривать как электрод первого рода, обратимый относительно катиона. Рассмотрим, например, хлоридсеребряный электрод Cl–(aq) | AgCl | Ag как электрод первого рода. Протекающая на электроде реакция будет иметь вид: Ag+ + e– Потенциал этого электрода, как электрода первого рода
Активность ионов серебра в растворе, содержащем ионы хлора, можно рассчитать из произведения растворимости (K s) соли AgCl
Поэтому потенциал хлоридсеребряного электрода равен:
Сравнивая полученные выражения, можно найти связь равновесных стандартных потенциалов электродов первого и второго рода, имеющих в основе один и тот же металл.
К электродам второго рода относятся и оксидныеэлектроды, состоящие из металла, покрытого оксидом этого металла, и находящемся в растворе, содержащем гидроксид-ионы. Например, ртутно-оксидный электрод второго рода: OH- | Hg2O, Hg, который обратим относительно гидроксид-ионов. Электродная реакция Hg2O + Н2О + 2 e– Потенциал электрода
Электроды второго рода часто используются в лабораторной практике как электроды сравнения (относительно электродов сравнения устанавливается или измеряется потенциалы других электродов), это связано с надежностью их работы, хорошей воспроизводимостью потенциала и простотой изготовления. При использовании различных электродов сравнения электродные потенциалы выражают либо в шкале принятого электрода сравнения, либо (когда это возможно) переводят измеренное значение в водородную шкалу.
Газовые электроды Газовые электроды выделяют по признаку того, что один из участников окислительно-восстановительной пары находится в газовой фазе. Примеры, H+(aq) | H2(г) | Pt(т) — водородный электрод; Cl–(aq) | Cl2(г) | Pt(т) — хлорный электрод. Примером газового электрода является, например, водородный электрод H+½ H2,Pt, на котором протекает реакция H+ +e = 1/2H2. Электродный потенциал водородного электрода зависит от относительного давления газа водорода:
В водородной шкале потенциалов значение На газовом хлорном электроде Cl-½Cl2, Pt протекает реакция: Cl2 + e= Cl- - е- = 1/2 Сl2, и электродный потенциал равен:
Как видно из приведенных выше электрохимических реакций, протекающих на электродах первого рода, одной из форм (окисленной или восстановленной) является простое соединение (атомы металла, неметалла или молекулы газа), а другой формой – ионы этого соединения. Ион-селективные электроды Ион-селективные электроды основаны на использовании специальных мембран, способных пропускать специфические ионы. Они обратимы относительно этих ионов, находящихся в растворе. Принципиальное отличие мембранных электродов от рассмотренных выше электродов состоит в том, что на поверхности мембран не протекает никаких акислительно-восстановительных процессов. Наибольшее применение в практике получили фтор-селективный и стеклянный электроды. Рассмотрим, например, как работает стеклянный электрод. Стеклянный электрод изготавливается из специальных сортов стекла. Стекло представляет собой тонкую мембрану, по обе стороны которой находятся растворы с активностями ионов водорода H+(aq) | стекло | HCl(aq) | AgCl | Ag На границе стекла с этими растворами возникают потенциалы
При одинаковом составе растворов следует ожидать равенства Стеклянный электрод применяется для определения рН растворов. В настоящее время с использованием стекол специального состава и различных ионитов разработаны ионоселективные электроды, при помощи которых определяется содержание в растворах многих катионов, анионов, органических веществ.
|
||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 651; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.008 с.) |

 Red(р-р),
Red(р-р),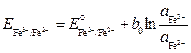 . (3.18)
. (3.18) . (3.19)
. (3.19)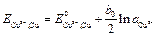 . (3.20)
. (3.20) . (3.21)
. (3.21) , (3.22)
, (3.22) . (3.23)
. (3.23) . (3.24)
. (3.24)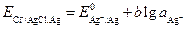 . (3.25)
. (3.25) .
.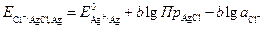 (3.26)
(3.26) . (3.27)
. (3.27) . (3.28)
. (3.28) . (3.29)
. (3.29) принято равным нулю.
принято равным нулю. . (3.30)
. (3.30) и
и  Например, стеклянная мембрана разделяет внешний раствор, содержащий ионы водорода, и внутренний стандартный раствор соляной кислоты, в котором, в свою очередь, находится хлорид-серебряный электрод:
Например, стеклянная мембрана разделяет внешний раствор, содержащий ионы водорода, и внутренний стандартный раствор соляной кислоты, в котором, в свою очередь, находится хлорид-серебряный электрод: и
и 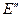 . Разность между этими потенциалами называют потенциалом стеклянного электрода:
. Разность между этими потенциалами называют потенциалом стеклянного электрода: . (3.31)
. (3.31)


