
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Порядки гетерогенно-каталитических реакцийСодержание книги
Поиск на нашем сайте
Рассмотрим реакцию, протекающую на поверхности катализатора: nАА+nВВ = nСС+nDD. Пусть процессы массопереноса не тормозят реакцию; поверхность катализатора равнодоступна; все вещества – газы. Так как реакция протекает на поверхности катализатора, то в уравнение формальной кинетики должны входить не парциальные давления реагентов, а обычно неизвестные концентрации реагентов на поверхности катализатора. Поэтому Лэнгмюр предложил использовать в этом случае вместо закона действующих масс аналогичный закон действующих поверхностей, согласно которому
где Рассмотрим, как влияет адсорбция на кинетическое уравнение скорости гетерогенно-каталитической реакции. Если лимитирующей стадией суммарного процесса является химическая реакция на поверхности катализатора, т.е. в адсорбционных стадиях устанавливается равновесие, тогда зависимость qi от рi может быть найдена по уравнению изотермы адсорбции этого компонента. Для примера рассмотрим расчет скорости простейшей мономолекулярной гетерогенной каталитической реакции: А ® В. В этом случае D n = 0, и скорость процесса v = kq А. Зависимость равновесной степени покрытия поверхности катализатора компонентом А, т.е. от p А по теории Лэнгмюра, выражается формулой:
где b А и b В – адсорбционные коэффициенты веществ А и В, тогда скорость процесса:
где k 1 = k × b А. Это уравнение позволяет качественно объяснить наблюдаемые на опыте зависимости кинетического порядка реакции от типа химического взаимодействия реагентов на поверхности катализатора. 1. Если адсорбция вещества Аслабая (b А<< 1), а продукты реакции не сорбируются катализатором (bBpB = 0), то bA∙pA+bB∙pB <<1, поэтому скорость реакции равна: v = k 1 p A, (5.73) то есть порядок мономолекулярной реакции равен 1. 2. При сильной адсорбции исходного вещества bAp A>>1, когда продукт реакции В адсорбируется слабо или вообще не адсорбируется, скорость гетерогенной каталитической реакции равна:
то есть наблюдается нулевой порядок реакции по реагирующему веществу А. 3. При средних значениях адсорбции исходного вещества, в соответствии с уравнением (5.72), порядок реакции должен быть дробным. 4. Если образующийся продукт реакции Всильно адсорбируется, а адсорбция вещества А слабая, то bB·рB >>(1 + bA·рA), тогда:
где
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 301; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.227.73 (0.006 с.) |


 , (5.70)
, (5.70)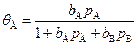 , (5.71)
, (5.71) , (5.72)
, (5.72) , (5.74)
, (5.74) , (5.75)
, (5.75) . В таких случаях порядок реакции по реагирующему веществу первый, но процесс тормозится образующимися при реакции веществами.
. В таких случаях порядок реакции по реагирующему веществу первый, но процесс тормозится образующимися при реакции веществами.


