
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионно – молекулярные (ионные) реакции обменаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицей 7.
Электролиты – вещества, которые в растворенном или расплавленном состоянии проводят электрический ток. При растворении в воде или других полярных растворителях электролиты подвергаются электролитической диссоциации, т.е. в большей или меньшей степени распадаются на положительно и отрицательно заряженные ионы – катионы и анионы. Уравнения диссоциации обычно записываются следующим образом:
Нужно иметь ввиду, что эти уравнения только приблизительно отображают подлинный процесс диссоциации, поскольку не показано участие молекул растворителя, без которого сама диссоциация невозможна. Электролиты практически полностью диссоциирующие на ионы называются сильными электролитами. К ним относятся большинство неорганических солей, гидроксиды щелочных металлов, растворимые гидроксиды щелочноземельных металлов, некоторые минеральные кислоты, например, Электролиты, диссоциирующие в растворах не полностью, называются слабыми электролитами. К ним относятся почти все органические кислоты, некоторые минеральные кислоты, например, В растворах слабых электролитов устанавливается равновесие между недиссоциированными молекулами и продуктами их диссоциации – ионами. В этом случае можно применить законы химического равновесия и записать выражение константы равновесия. Например, в водном растворе уксусной кислоты устанавливается равновесие:
которое характеризуется константой равновесия (константой диссоциации):
Величина В табл. 4 приведены значения констант диссоциации некоторых слабых электролитов. Количественно процесс электролитической диссоциации выражают с помощью степени диссоциации (
где n – число молекул, распавшихся на ионы, n0 – общее число растворенных молекул. Ионно-молекулярные, или просто ионные, уравнения реакций обмена отражают состояние электролита в растворе. В этих уравнениях сильные растворимые электролиты, поскольку они полностью диссоциированы, записывают в виде ионов, а слабые электролиты, малорастворимые и газообразные вещества записывают в молекулярной форме. В ионно-молекулярном уравнении одинаковые ионы из обеих его частей исключаются. При составлении ионно-молекулярных уравнений следует помнить, что сумма электрических зарядов в левой части уравнения должна быть равна сумме электрических зарядов в правой части уравнения. Пример 1. Написать ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: а) д) Решение: запишем уравнения взаимодействия указанных веществ в молекулярном виде: а) б) в) г) д) Отметим, что взаимодействие этих веществ возможно, ибо в результате происходит связывание ионов с образованием слабых электролитов ( В реакции (д) имеются два слабых электролита - а) б) в) г) д) Пример 2. Составьте молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения: а) б) в) г) Решение: В левой части данных ионно-молекулярных уравнений указаны свободные ионы, которые образуются при диссоциации растворимых сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например: а) б) в) г)
Контрольные вопросы 141. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) хлоридом бария и сульфатом алюминия; б) фосфорной кислотой и нитратом кальция; в) ацетатом калия и серной кислотой. 142. Какое из веществ: 143. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) б) в) 144. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) 145. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) б) Н б) в)
Гидролиз солей Для решения задач этого раздела рекомендуем воспользоваться литературой 4, 6, 8, 14 и таблицами 4,5. Вода является очень слабым электролитом, степень ее диссоциации равна
или с учетом гидратации: 2 На основании законов химического равновесия получим выражение константы диссоциации воды:
отсюда
По данным измерения электропроводности при температуре
Если При Более удобен способ выражения реакции среды с помощью отрицательного десятичного логарифма концентрации водородных ионов, именуемого водородным показателем рН:
В нейтральной среде рН = 7; в кислой – рН < 7; в щелочной – рН > 7. Растворениеразличных веществ в воде часто сопровождается химическим взаимодействием обменного характера. Процессы подобного типа объединяют под общим названием гидролиза. Гидролиз – это химический процесс обменного разложения вещества с водой. Гидролиз солей – частный случай взаимодействия растворенных солей с водой, где их составные части соединяются с составными частями воды с образованием соответствующего слабого электролита. Реакцию гидролиза соли можно представить общим уравнением: МА + НОН ⇄ МОН + НА, Соль вода основание кислота где М – металл, А – остаток кислоты (анион). Соли, образованные сильными кислотами и сильными основаниями (например, Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: а) Решение: а) Цианид калия
или в молекулярной форме
В результате гидролиза в растворе появляется некоторый избыток ионов б) Карбонат натрия
или в молекулярной форме
В растворе появляется избыток ионов OH в) Сульфат цинка
или в молекулярной форме 2 В растворе появляется избыток ионов водорода, поэтому раствор Пример 2. Какие продукты образуются при смешивании растворов Решение: Соль
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы
молекулярное уравнение: 2
Контрольные вопросы 161. Составьте ионно-молекулярное и молекулярное уравнения гидролиза соли, раствор которой имеет: а) щелочную реакцию; б) кислую реакцию. 162. Kакое значение 163. Какие из солей 164. При смешивании растворов 165. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: 166. Какое значение
|
||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 482; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.78.203 (0.009 с.) |


 ;
; 

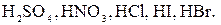
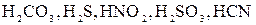 , многие основания металлов, а также
, многие основания металлов, а также  .
.  ⇄
⇄ 
 .
. зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы: чем выше
зависит от природы электролита и растворителя, от температуры, но не зависит от концентрации раствора. Она характеризует способность данного электролита распадаться на ионы: чем выше  , тем легче электролит диссоциирует.
, тем легче электролит диссоциирует. ), т.е. доли молекул, распавшихся на ионы. Степень диссоциации представляют в процентах или в долях единицы:
), т.е. доли молекул, распавшихся на ионы. Степень диссоциации представляют в процентах или в долях единицы: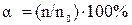 ,
, и
и  ; б)
; б) 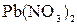 и
и  ; в)
; в)  и
и 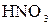 ; г)
; г)  и
и  ;
;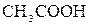 и
и  +
+ 

 +
+ 
 +
+ 
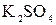 +
+  ↑ +
↑ +  +
+ 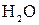 ,
, 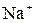 и
и  ; б)
; б)  ; в)
; в)  ; г) K+ и
; г) K+ и  д)
д)  +
+  =
= 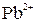 +
+  =
= 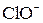 +
+  + 2
+ 2  +
+ 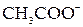 +
+  + 2
+ 2  +
+  =
= 
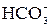 +
+  +
+  +
+ 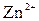 +
+  + 2
+ 2  +
+ 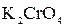 =
=  + 2
+ 2 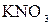
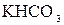 +
+  =
=  +
+  +
+  ,
,  ,
,  ,
,  - взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций.
- взаимодействует с раствором гидроксида натрия? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. =
=  + 2
+ 2  и
и  и
и  ; в)
; в)  и
и  +
+  +
+ 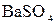
 +
+  + 2
+ 2 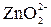 + 2
+ 2  +
+ 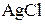
 + 2
+ 2  + 2
+ 2  + 2
+ 2  в)
в)  и
и  и
и  и
и  и
и  .
.
 и
и 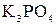 и
и  ; в)
; в) 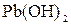 и
и  и
и  и
и  и
и  и
и 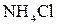 и
и  и
и  ; в)
; в) 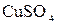 и
и  +
+ 
 б)
б)  +
+ 

 и
и  и
и  и
и  ; в)
; в)  и
и  . Полярные молекулы воды в очень небольшой степени диссоциируют на ионы:
. Полярные молекулы воды в очень небольшой степени диссоциируют на ионы: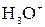 +
+  ,
,


 , а молярная концентрация чистой воды
, а молярная концентрация чистой воды  . Получаем значение
. Получаем значение 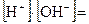


 Произведение
Произведение  называется ионным произведением воды.
называется ионным произведением воды. , то концентрация каждого из ионов воды равна
, то концентрация каждого из ионов воды равна  =10-7 моль/л. Ионы водорода являются носителем кислотных свойств, а гидроксид-ионы – щелочных, следовательно, при равенстве их концентраций реакция среды раствора является нейтральной.
=10-7 моль/л. Ионы водорода являются носителем кислотных свойств, а гидроксид-ионы – щелочных, следовательно, при равенстве их концентраций реакция среды раствора является нейтральной. моль/л реакция среды будет кислой, а при
моль/л реакция среды будет кислой, а при 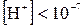 - щелочной. Таким образом, концентрация ионов водорода является мерой его кислотности или щелочности.
- щелочной. Таким образом, концентрация ионов водорода является мерой его кислотности или щелочности.
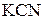 ; б)
; б)  . Определите реакцию среды растворов этих солей.
. Определите реакцию среды растворов этих солей. и сильного основания
и сильного основания  и анионы
и анионы  . Катионы
. Катионы  и сильного основания
и сильного основания  +
+  , поэтому раствор
, поэтому раствор  +
+  и
и  +
+ 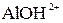 +
+  +
+  +
+  =
= 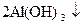 +
+ 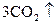
 имеют растворы следующих солей:
имеют растворы следующих солей:  ,
,  ,
,  ,
, 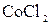 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение
подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение  имеют растворы этих солей?
имеют растворы этих солей? ,
,  ,
,  . Какое значение
. Какое значение  . Какое значение
. Какое значение  и
и  + 2
+ 2  +2
+2  ,
,  ,
,  подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение
подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение  добавили следующие вещества: а)
добавили следующие вещества: а) 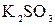 ,
,  +
+  +
+  ; г)
; г)  ; г)
; г) 


