

Мы поможем в написании ваших работ!
ЗНАЕТЕ ЛИ ВЫ?
|
Условия синтеза некоторых полимеров
| Название полимера и его элементарное звено
| Название и формула
исходного мономера
| Условия синтеза
полимера
| | Карбоцепные полимеры
| Полиэтилен
 (полиэтилен высокого давления и полиэтилен низкого давления)
(полиэтилен высокого давления и полиэтилен низкого давления) 
| Этилен

| Радикальная полимеризация при высоком давлении (при   ) или ионная полимеризация при небольшом давлении в присутствии катализаторов. ) или ионная полимеризация при небольшом давлении в присутствии катализаторов.
| Полипропилен

| Пропилен
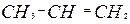
| Полимеризация в растворе в присутствии катализаторов.
| | Название полимера и его элементарное звено
| Название и формула исходного мономера
| Условие синтеза
полимера
| Полиизобутилен
 
| Изобутилен

| Ионная полимеризация в растворе в присутствии катализаторов.
| Полибутадиен 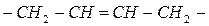
| Бутадиен-1,3 (дивинил)

| Радикальная полимеризация в присутствии пероксидных инициаторов 
| Полистирол

| Стирол (винилбензол)

| Радикальная полимеризация блочным или эмульсионным методом в присутствии пероксидных инициаторов.
| Полиизопрен (1,4-транс-)
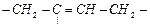
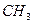
| Изопрен

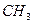
| Стереоспецифическая полимеризация в растворе в присутствии пероксидных инициаторов.
| Поливинилхлорид

| Винилхлорид

| Суспензионная или эмульсионная полимеризация в присутствии пероксидных инициаторов.
| Политетрафторэтилен

| Тетрафторэтилен

| Эмульсионная полимеризация в присутствии пероксидных инициаторов.
| Полихлоропен


| Хлоропрен
(2-хлорбутадиен-1,3)

| Полимеризация в присутствии пероксидных инициаторов.
| Поливинилацетат

| Винилацетат

| Радикальная полимеризация при нагревании в присутствии пероксидных инициаторов.
| Полиметилметакрилат

| Метилметакрилат

| Радикальная полимеризация при нагревании в присутствии пероксидных инициаторов.
| | Название полимера и его элементарное звено
| Название и формула исходного мономера
| Условие синтеза
полимера
| Полиакрилонитрил

| Акрилонитрил

| Эмульсионная радикальная полимеризация в присутствии пероксидных инициаторов.
| Фенолоформальдегидные олигомеры
 
| Фенол 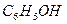 Формальдегид
Формальдегид  
| Поликонденсация при нагревании в присутствии кислот или оснований.
| | Гетероцепные полимеры.
| Полиформальдегид
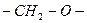
| Формальдегид

| Полимеризация абсолютно сухого  в безводной среде в присутствии третичных аминов. в безводной среде в присутствии третичных аминов.
| Карбамидформальдегидные полимеры

| Карбамид
 Формальдегид
Формальдегид 
| Поликонденсация при нагревании в присутствии кислот или оснований.
| Поли-  - капроамид (полиамид-6, капрон) - капроамид (полиамид-6, капрон)

| Капролактам
 |
| 

| Полимеризация в присутствии воды (активатор).
| Полигексаметиленадипамид

| Адипиновая кислота
 Гексаметилендиамин
Гексаметилендиамин

| Поликонденсация с использованием кислых и дегидратирующих катализаторов.
| Полиорганосилоксаны
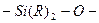 (R-ароматические и алифатические радикалы)
(R-ароматические и алифатические радикалы)
| Силандиолы

| Поликонденсация при нагревании.
| Полиэтилентерефталат
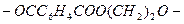
| Диметиловый эфир терефталевой кислоты
 Этиленгликоль
Этиленгликоль

| Поликонденсация при   (до получения расплава заданной вязкости). (до получения расплава заданной вязкости).
| | Название полимера и его элементарное звено
| Название и формула исходного мономера
| Условие синтеза
полимера
| Поликарбонаты
-O-R-O-CO-
(здесь R=

| Фосген  двухатомные фенолы, например дифенилолпропан. двухатомные фенолы, например дифенилолпропан.

| Поликонденсация при   в присутствии катализаторов четвертичных аммониевых оснований. в присутствии катализаторов четвертичных аммониевых оснований.
| Эпоксидные олигомеры
 \ /
\ /


 \ /
\ /
 (R- см. Поликарбонаты)
(R- см. Поликарбонаты)
| Эпихлоргидрин
 \ /
\ /
 дифенилолпропан
дифенилолпропан
| Поликонденсация в щелочной среде.
|
Контрольные вопросы:
301. Дайте определение мономера, олигомера и полимера; элементарного звена; молекулярной массы полимера. Приведите примеры. Охарактеризуйте понятие молекулярно-массового распределения полимеров.
302. Специфика свойств полимеров, их отличия от низкомолекулярных веществ.
303. Классификация полимеров по изменению свойств при нагревании. Характеристика процессов, протекающих в полимерах различного типа при нагревании. Примеры.
304. Способы получения полимеров. Степень полимеризации. Способы регулирования степени полимеризации.
305. Сополимеры. Классификация сополимеров. Примеры.
306. Процесс полимеризации. Механизм, способы инициирования, примеры реакции. Важнейшие полимеры, получаемые реакцией полимеризации.
307. Процесс поликонденсации. Раскройте механизм поликонденсации на примере получения фенол - формальдегидных смол.
308. Отличия процессов полимеризации и поликонденсации.
309. Классификация полимеров по строению макромолекулы.
310. Особенности химических реакций полимеров. Классификация химических процессов в полимерах, примеры.
311. Реакции сшивания полимеров (отверждение, вулканизация). Механизм и регулирование процесса, изменение физико – химических свойств в ходе реакции сшивания.
312. Три физических состояния аморфных полимеров. Температурные интервалы перехода из одного состояния в другое; изменение физико – химических свойств при этом.
313. Диффузия в полимерах. Растворимость полимеров. Процесс набухания. Структура растворов полимеров.
314. Механические свойства полимеров. Деформационные свойства полимеров. Упругая и неупругая деформации. Релаксационные процессы.
315. Деструкция полимеров. Основные виды деструкции. Стабилизация полимеров.
316. Полиэтилен. Способы получения, уравнение процесса. Физико – химические свойства, области применения в строительных материалах.
317. Акрилаты. Классификация. Физико – химические свойства, области применения в строительных материалах. Полиметилметакрилат: получение, уравнение процесса.
318. Поливинилхлорид и поливинилацетат. Получение. Физико – химические свойства, области применения в строительных материалах.
319. Полиуретаны. Получение. Физико – химические свойства, области применения в строительных материалах.
320. Полистирол. Получение. Физико – химические свойства, области применения в строительных материалах.
Дисперсные системы.
Для ответов на контрольные вопросы рекомендуем воспользоваться литературой 4, 9, 12, 16
Дисперсная система (ДС) – это система, в которой хотя бы одно вещество находится в раздробленном состоянии. Степень измельчения вещества характеризуется степенью дисперсности - величина обратная размеру частиц.
По степени дисперсности все ДС располагаются в непрерывный ряд:
| Название
| r, см
> 10-3
10-4 ¸ 10-5
10-5 ¸ 10-7
<10-7
| | Гетерогенные
cистемы
Гомогенные
системы
| 1.Грубодисперсные
2.Микрогетерогенные
3.Высокодисперсные (коллоиды, золи)
4. Молекулярнодисперсные
(истинные растворы)
| | | | | В гетерогенных ДС между дисперсной фазой (раздробленные частицы) и дисперсионной средой (сплошная среда) имеется поверхность раздела. Чем больше дисперсность, тем больше площадь этой поверхности.
Пример 1. Вычислить дисперсность, удельную и общую площадь поверхности частиц золя, полученного при дроблении 0,5 г вещества на частицы шарообразной формы диаметром  . Плотность вещества 19320 кг/м3. . Плотность вещества 19320 кг/м3.
Решение: Степень дисперсности - величина обратная размеру частиц. 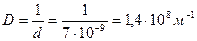
Удельная поверхность Sуд равна отношению площади поверхности раздробленных частиц S к объему дисперсной фазы V или ее массы m.
Для сферических частиц с радиусом r:

Находим объем вещества: 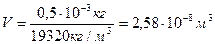
Находим общую площадь поверхности:

И удельную площадь, отнесенную к массе:

ДС классифицируют по агрегатному состоянию дисперсной фазы и среды: суспензии, лиозоли (Т-Ж), эмульсии (Ж-Ж), пены (Г-Ж), гели (Ж-Т), сплавы, солеозоли (Т-Т), твердые пены (Г-Т), и две разновидности аэрозолей (Т-Г и Ж-Г), где Т, Ж, Г - твердое, жидкое и газообразное тела.
Существуют лиофильные системы, в которых частицы имеют тесную связь с растворителем, и лиофобные, в которых частицы практически не растворяются в растворителе. Лиофильные системы являются термодинамически устойчивыми и образуются самопроизвольно. Лиофобные золи получают путем дробления частиц, исходя из грубодисперсных систем – диспергирование, или же путем агрегации из более мелких частиц - конденсация. В обоих случаях получаемая лиофобная ДС должна быть стабилизирована. Это достигается адсорбцией на поверхности частиц дисперсной фазы ПАВ (коллоидная защита) или ионов электролита-стабилизатора. Стабилизатор создает механический или электростатический барьер на поверхности частиц, препятствующий их слипанию.
Пример 2. Золь иодида серебра получен при добавлении к 30 мл 0,006 М раствора  40 мл 0,004 М раствора 40 мл 0,004 М раствора 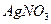 . Определить заряд частиц полученного золя и написать формулу его мицеллы. Какой электролит является стабилизатором для данного золя? . Определить заряд частиц полученного золя и написать формулу его мицеллы. Какой электролит является стабилизатором для данного золя?
Решение: Золь получен методом конденсации по реакции обмена:

Нерастворимые молекулы хлорида серебра образуют ядро коллоидной частицы  . Для того чтобы вместо осадка . Для того чтобы вместо осадка 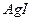 образовался коллоидный раствор, необходимо условие: один из реагентов должен быть в избытке. Рассчитаем число молей нитрата серебра и иодида калия: образовался коллоидный раствор, необходимо условие: один из реагентов должен быть в избытке. Рассчитаем число молей нитрата серебра и иодида калия:


т.к.  > >  следовательно, следовательно,  взят в избытке и является стабилизатором. взят в избытке и является стабилизатором.
Согласно правилу избирательной адсорбции Пескова – Фаянса, на поверхности ядра будут адсорбироваться ионы  и частицы золя приобретают отрицательный заряд. Противоионами являются катионы и частицы золя приобретают отрицательный заряд. Противоионами являются катионы  . В целом мицелла нейтральна. Мицелла имеет строение: . В целом мицелла нейтральна. Мицелла имеет строение:
 , ,
где  -ядро; -ядро;   - гранула; - гранула;  - потенциалопределяющие (зарядообразующие) ионы, каким будет заряд этих ионов, таким будет и заряд гранулы; - потенциалопределяющие (зарядообразующие) ионы, каким будет заряд этих ионов, таким будет и заряд гранулы;  - адсорбционный слой – неподвижный; - адсорбционный слой – неподвижный; 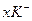 - диффузный слой, подвижный. - диффузный слой, подвижный.
Заряд коллоидных частиц можно установить экспериментально. Под действием постоянного электрического поля наблюдается перемещение гранул к противоположно заряженному электроду, диффузный слой передвигается в обратном направлении, увлекая за собой среду. Это явление называется электрофорез. Таким образом, приведенная в примере 2 гранула  имеет отрицательный заряд и при электрофорезе движется к аноду, а среда – к катоду. имеет отрицательный заряд и при электрофорезе движется к аноду, а среда – к катоду.
В случае неподвижных частиц, передвигается только диффузный слой, это явление называется электроосмос.
Если заряд коллоидной частицы уменьшить до некоторого минимума, то устойчивость коллоидного раствора нарушится, произойдет слипание и соединение частиц в более крупные агрегаты – коагуляция (коалесценция) и их осаждение - седиментация. Коагуляция золя происходит при добавлении электролита, добавлении противоположно заряженного золя, изменении температуры и др.
Коагуляция электролитами происходит по определенным правилам:
1. Коагуляция начинается при определенной концентрации электролита. Минимальная концентрация электролита, вызывающая в системе коагуляцию, называется порогом коагуляции  . Иногда вместо порога коагуляции используют величину γ, называемую коагулирующей способностью: . Иногда вместо порога коагуляции используют величину γ, называемую коагулирующей способностью: 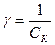 . .
2. Коагуляцию вызывают ионы - коагулянты, противоположные по знаку потенциалопределяющим ионам и заряду гранулы.
3. Порог коагуляции обратно пропорционален шестой степени заряда коагулирующего иона. По правилу Шульце-Гарди пороги коагуляции одно-, двух-, трех-, четырехзарядных ионов соотносятся как:

Соответственно коагулирующая способность подчиняется следующему соотношению: 
Пример 3. Пороги коагуляции некоторого золя электролитами   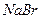 равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы? равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы?
Решение:Рассчитаем коагулирующую способность веществ: 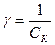
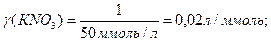


Таким образом,  обладает наибольшей коагулирующей способностью. обладает наибольшей коагулирующей способностью.
Так как анионы во всех данных электролитах однозарядны, то можно предположить, что ионами-коагулянтами являются катионы, а следовательно, заряд коллоидной частицы – отрицательный.
Коагулирующие способности ионов-коагулянтов относятся между собой как: 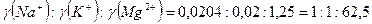 что соответствует правилу Шульце-Гарди. что соответствует правилу Шульце-Гарди.
При смешивании двух коллоидных растворов, состоящих из частиц противоположного заряда, заряды гранул нейтрализуются и происходит взаимная коагуляция.
Процесс, обратный коагуляции, называется пептизацией.
Контрольные вопросы
321. Как классифицируются дисперсные системы в зависимости от размера частиц и агрегатного состояния дисперсной фазы и дисперсионной среды? Приведите примеры дисперсных систем разных типов, которые используются в строительстве.
322. Охарактеризуйте коллоидное состояние вещества. Напишите формулу коллоидной мицеллы гидрозоля диоксида кремния, который широко распространен в природе. Приведите примеры других природных коллоидов.
323. В чем состоит сущность методов диспергирования? Какое оборудование применяют для этого? В чем недостатки диспергационных методов?
324. Аэрозоль получен распылением 0,5 кг угля в 1 м3 воздуха. Частицы аэрозоля имеют шарообразную форму, диаметр частицы  м. Определите удельную поверхность и дисперсность аэрозоля. Плотность угля 1,8 кг/м3. м. Определите удельную поверхность и дисперсность аэрозоля. Плотность угля 1,8 кг/м3.
325. В цементе 60-80% частиц имеют размеры от 1 до 40 мкм. Какова дисперсность этих частиц? Как степень дисперсности влияет на свойства вяжущих материалов?
326. Дайте название дисперсной системе, частицы которой имеют кубическую форму и размер 10 нм. Какова общая и удельная площадь поверхности этих частиц при общем объеме 1 см3?
327. Золь кремниевой кислоты  был получен при взаимодействии растворов был получен при взаимодействии растворов 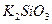 и и 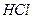 . Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду. Какой метод был использован при получении данного золя? . Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду. Какой метод был использован при получении данного золя?
328. Составьте формулу мицеллы золя гидроксида алюминия, полученного при глубоком гидролизе сульфата алюминия.
329. Что такое пептизация? Объясните, какие из перечисленных соединений могут вызвать пептизацию свежеполученного рыхлого осадка гидроксида железа: 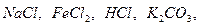  олеат калия. Приведите формулу полученной мицеллы. олеат калия. Приведите формулу полученной мицеллы.
330. При длительном хранении насыщенных растворов  в открытых емкостях в них появляется муть: образуются карбонаты вследствие поглощения в открытых емкостях в них появляется муть: образуются карбонаты вследствие поглощения  углекислого газа из воздуха. Почему эти карбонаты не оседают? Напишите формулы мицелл и укажите знак заряда коллоидных частиц. Как можно вызвать оседание карбонатов из этих систем? углекислого газа из воздуха. Почему эти карбонаты не оседают? Напишите формулы мицелл и укажите знак заряда коллоидных частиц. Как можно вызвать оседание карбонатов из этих систем?
331. Что такое агрегативная и седиментационная устойчивость, какая связь между ними? Приведите примеры систем седиментационноустойчивых и неустойчивых. Для каких практических целей можно использовать седиментацию?
332. Для осветления воды в нее вводят  , ,  или или  после чего происходит интенсивное выпадение осадка. Объясните это явление, исходя из того, что частички взвеси в природной воде имеют отрицательные электрические заряды, а вводимые соли при растворении подвергаются гидролизу. после чего происходит интенсивное выпадение осадка. Объясните это явление, исходя из того, что частички взвеси в природной воде имеют отрицательные электрические заряды, а вводимые соли при растворении подвергаются гидролизу.
333. При нагревании воды (особенно озерной или речной) до   происходит интенсивное образование бурых хлопьев. Объясните это явление. Почему такое явление не наблюдается при нагревании дистиллированной воды? происходит интенсивное образование бурых хлопьев. Объясните это явление. Почему такое явление не наблюдается при нагревании дистиллированной воды?
334. Установлено, что знак электрических зарядов глобул натурального латекса отрицательный. Каким электролитом выгоднее отделять каучук от серума: 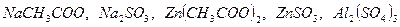 . У какого электрода будет концентрироваться каучук, если латекс поместить в сильное электрическое поле? . У какого электрода будет концентрироваться каучук, если латекс поместить в сильное электрическое поле?
335. Для закрепления грунта, его сначала пропитали раствором жидкого стекла, а затем, раствором хлорида кальция, написать уравнения, составить формулу мицеллы, объяснить происходящие явления.
336. Как расположены пороги коагуляции в ряду  для золя кремниевой кислоты, частицы которого заряжены отрицательно? для золя кремниевой кислоты, частицы которого заряжены отрицательно?
337. Пороги коагуляции золя сульфатом натрия и хлоридом калия соответственно равны 0,32 ммоль/л и 20,50 ммоль/л. Определите знак заряда коллоидных частиц золя. Вычислите величины коагулирующей способности этих электролитов и сопоставьте их соотношение с вычисленными по правилу Шульце-Гарди. Будет ли более эффективным применение сульфата алюминия для коагуляции данного золя?
338. Что такое электрофорез? Укажите области его применения.
339. Что такое элекроосмос? Объясните механизм осушения строительных площадок и стен зданий методом электроосмоса.
340. В чем заключаются явления тиксотропии и синерезиса для студней? Приведите примеры тиксотропных свойств грунта и строительных материалов.
ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ ЗАДАНИЙ
| Номер варианта
| Номер контрольного задания
| Номер задач, относящихся к данному заданию
| |
| I
II
| 1, 21, 41, 61, 81, 101, 121,141, 161
181, 201, 221, 241, 261, 281, 301, 321
| |
| I
II
| 2, 22, 42, 62, 82, 102, 122, 142, 162
182, 202, 222, 242, 262, 282, 302, 322
| |
| I
II
| 3, 23, 43, 63, 83, 103, 123, 143, 163
183, 203, 223, 243, 263, 283, 303, 323
| |
| I
II
| 4, 24, 44, 64, 84, 104, 124, 144, 164
184, 204, 224, 244, 264, 284, 304, 324
| |
| I
II
| 5, 25, 45, 65, 85, 105, 125, 145, 165
185, 205, 225, 245, 265, 285, 305, 325
| |
| I
II
| 6, 26, 46, 66, 86, 106, 126, 146, 166
186, 206, 226, 246, 266, 286, 306, 326
| |
| I
II
| 7, 27, 47, 67, 87, 107, 127, 147, 167
187, 207, 227, 247, 267, 287, 307, 327
| |
| I
II
| 8, 28, 48, 68, 88, 108, 128, 148, 168
188, 208, 228, 248, 268, 288, 308, 328
| |
| I
II
| 9, 29, 49, 69, 89, 109, 129, 149, 169
189, 209, 229, 249, 269, 289, 309, 329
| |
| I
II
| 10, 30, 50, 70, 90, 110, 130, 150, 170
190, 210, 230, 250, 270, 290, 310, 330
| |
| I
II
| 11, 31, 51, 71, 91, 111, 131, 151, 171
191,211, 231, 251, 271, 291, 311, 331
| |
| I
II
| 12, 32, 52, 72, 92, 112, 132, 152, 172
192, 212, 232, 252, 272, 292, 312, 332
| |
| I
II
| 13, 33, 53, 73, 93, 113, 133, 153, 173
193, 213, 233, 253, 273, 293, 313, 333
| |
| I
II
| 14, 34, 54, 74, 94, 114, 134, 154, 174
194, 214, 234, 254, 274, 294, 314, 334
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 15, 35, 55, 75, 95, 115, 135, 155, 175
195, 215, 235, 255, 275, 295, 315, 335
| |
| I
II
| 16, 36, 56, 76, 96, 116, 136, 156, 176
196, 216, 236, 256, 276, 296, 316, 336
| |
| I
II
| 17, 37, 57, 77, 97, 117, 137, 157, 177
197, 217, 237, 257, 277, 297, 317, 337
| |
| I
II
| 18, 38, 58, 78, 98, 118, 138, 158, 178
198, 218, 238, 258, 278, 298, 318, 338
| |
| I
II
| 19, 39, 59, 79, 99, 119, 139, 159, 179
199, 219, 239, 259, 279, 299, 319, 339
| |
| I
II
| 20, 40, 60, 80, 100, 120, 140, 160, 180
200, 220, 240, 260, 280, 300, 320, 340
| |
| I
II
| 1, 22, 43, 64, 85, 106, 127, 148, 169
190, 211, 222, 243, 264, 285, 306, 327
| |
| I
II
| 2, 23, 44, 65, 86, 107, 128, 149, 170
191, 212, 223, 244, 265, 286, 307, 328
| |
| I
II
| 3, 24, 45, 66, 87, 108, 129, 150, 171
192, 213, 224, 245, 266, 287, 308, 329
| |
| I
II
| 4, 25, 46, 67, 88, 109, 130, 151, 172
193, 214, 225, 246, 267, 288, 309, 330
| |
| I
II
| 5, 26, 47, 68, 89, 110, 131, 152, 173
194, 215, 226, 247, 268, 289, 310, 331
| |
| I
II
| 6, 27, 48, 69, 90, 111, 132, 153, 174
195, 216, 227, 248, 269, 290, 311, 332
| |
| I
II
| 7, 28, 49, 70, 91, 112, 133, 154, 175
196, 217, 228, 249, 270, 291, 312, 333
| |
| I
II
| 8, 29, 50, 71, 92, 113, 134, 155, 176
197, 218, 229, 250, 271, 292, 313, 334
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 9, 30, 51, 72, 93, 114, 135, 156, 177
198, 219, 230, 251, 272, 293, 314, 335
| |
| I
II
| 10, 31, 52, 73, 94, 115, 136, 157, 178
199, 220, 231, 252, 273, 294, 315, 336
| |
| I
II
| 11, 32, 53, 74, 95, 116, 137, 158, 179
200, 201, 232, 253, 274, 295, 316, 337
| |
| I
II
| 12, 33, 54, 75, 96, 117, 138, 159, 180
181, 202, 233, 254, 275, 296, 317, 338
| |
| I
II
| 13, 34, 55, 76, 97, 118, 139, 160, 161
182, 203, 234, 255, 276, 297, 318, 339
| |
| I
II
| 14, 35, 56, 77, 98, 119, 140, 141, 162
183, 204, 235, 256, 277, 298, 319, 340
| |
| I
II
| 15, 36, 57, 78, 99, 120, 121, 142, 163
184, 205, 236, 257, 278, 299, 320, 322
| |
| I
II
| 16, 37, 58, 79, 100, 101, 122, 143, 164
185, 206, 237, 258, 279, 300, 301, 323
| |
| I
II
| 17, 38, 59, 80, 81, 102, 123, 144, 165
186, 207, 238, 259, 280, 281, 302, 324
| |
| I
II
| 18, 39, 60, 65, 86, 107, 128, 145, 166
187, 208, 239, 260, 261, 282, 303, 325
| |
| I
II
| 19, 40, 44, 66, 87, 108, 129, 146, 167
188, 209, 240, 241, 262, 283, 304, 326
| |
| I
II
| 20, 23, 45, 67, 88, 109, 130, 147, 168
189, 210, 221, 242, 263, 284, 305, 327
| |
| I
II
| 2, 24, 46, 68, 89, 110, 131, 148, 170
190, 201, 223, 241, 265, 281, 306, 328
| |
| I
II
| 3, 25, 47, 69, 90, 111, 132, 149, 171
191, 202, 224, 242, 266, 282, 307, 329
| |
| I
II
| 4, 26, 48, 70, 91, 112, 133, 150, 172
192, 203, 225, 243, 267, 283, 308, 330
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 5, 27, 49, 71, 92, 113, 134, 151, 173
193, 204, 226, 244, 268, 284, 309, 331
| |
| I
II
| 6, 28, 50, 72, 93, 114, 135, 152, 174
194, 205, 227, 245, 269, 285, 310, 332
| |
| I
II
| 7, 29, 51, 73, 94, 115, 136, 153, 175
195, 206, 228, 246, 270, 286, 311, 333
| |
| I
II
| 8, 30, 52, 74, 95, 116, 137, 154, 176
196, 207, 229, 247, 271, 287, 312, 334
| |
| I
II
| 9, 31, 53, 75, 96, 117, 138, 155, 177
197, 208, 230, 248, 272, 288, 313, 335
| |
| I
II
| 10, 32, 54, 76, 97, 118, 139, 156, 178
198, 209, 231, 249, 273, 289, 314, 336
| |
| I
II
| 11, 33, 55, 77, 98, 119, 140, 157, 179
199, 210, 232, 250, 274, 290, 315, 337
| |
| I
II
| 12, 34, 56, 78, 99, 120, 122, 158, 180
200, 211, 233, 251, 275, 291, 316, 338
| |
| I
II
| 13, 35, 57, 79, 100, 103, 121, 159, 169
182, 212, 234, 252, 276, 292, 317, 321
| |
| I
II
| 14, 36, 58, 80, 85, 104, 123, 160, 161
183, 213, 235, 253, 277, 293, 318, 322
| |
| I
II
| 15, 37, 59, 61, 84, 105, 124, 141, 162
184, 214, 236, 254, 278, 294, 319, 323
| |
| I
II
| 16, 38, 60, 62, 83, 106, 125, 143, 163
185, 215, 237, 255, 279, 295, 320, 324
| |
| I
II
| 17, 33, 41, 63, 82, 101, 126, 142, 164
186, 216, 238, 256, 280, 296, 301, 325
| |
| I
II
| 18, 40, 42, 61, 81, 102, 127, 144, 165
187, 217, 239, 257, 271, 297, 302, 326
| |
| I
II
| 19, 21, 43, 62, 87, 103, 128, 145, 166
188, 218, 240, 258, 272, 298, 303, 327
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 20, 22, 41, 63, 88, 104, 129, 146, 167
189, 219, 223, 259, 273, 299, 304, 328
| |
| I
II
| 1, 24, 42, 64, 89, 105, 130, 147, 168
190, 220, 222, 260, 274, 300, 305, 329
| |
| I
II
| 3, 25, 43, 65, 90, 106, 131, 148, 169
191, 201, 221, 250, 275, 281, 301, 330
| |
| I
II
| 4, 26, 44, 66, 91, 107, 132, 149, 170
192, 202, 222, 251, 276, 282, 302, 331
| |
| I
II
| 5, 27, 45, 67, 92, 108, 133, 150, 171
193, 203, 223, 252, 277, 283, 303, 332
| |
| I
II
| 6, 28, 46, 68, 93, 109, 134, 151, 172
194, 204, 224, 253, 278, 284, 304, 333
| |
| I
II
| 7, 29, 47, 69, 94, 110, 135, 152, 173
195, 205, 225, 254, 279, 285, 305, 334
| |
| I
II
| 8, 30, 48, 70, 95, 111, 136, 153, 174
196, 206, 226, 255, 280, 286, 306, 335
| |
| I
II
| 9, 31, 49, 71, 96, 112, 137, 154, 175
197, 207, 227, 256, 261, 287, 307, 336
| |
| I
II
| 10, 32, 50, 72, 97, 113, 138, 155, 176
198, 208, 228, 257, 262, 288, 308, 337
| |
| I
II
| 11, 33, 51, 73, 98, 114, 139, 156, 177
199, 209, 229, 258, 263, 289, 309, 338
| |
| I
II
| 12, 34, 52, 74, 99, 115, 140, 157, 178
200, 210, 230, 259, 264, 290, 310, 339
| |
| I
II
| 13, 35, 53, 75, 100, 116, 121, 158, 179
181, 211, 231, 260, 265, 291, 311, 340
| |
| I
II
| 14, 36, 54, 76, 86, 117, 122, 159, 180
182, 212, 232, 241, 266, 292, 312, 321
| |
| I
II
| 15, 37, 55, 77, 85, 118, 123, 160, 162
183, 213, 233, 242, 267, 293, 313, 322
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 16, 38, 56, 78, 84, 119, 124, 142, 161
184, 214, 234, 243, 268, 294, 314, 323
| |
| I
II
| 17, 39, 57, 79, 83, 120, 125, 141, 163
185, 215, 235, 244, 269, 295, 315, 324
| |
| I
II
| 18, 40, 58, 80, 82, 101, 126, 143, 164
186, 216, 236, 245, 270, 296, 316, 325
| |
| I
II
| 19, 23, 59, 61, 81, 102, 127, 144, 165
187, 217, 237, 246, 271, 297, 317, 326
| |
| I
II
| 20, 21, 60, 62, 100, 103, 128, 145, 166
188, 218, 238, 247, 272298, 318, 327
| |
| I
II
| 4, 22, 51, 63, 99, 104, 129, 146, 167
189, 219, 239, 248, 273, 300, 319, 328
| |
| I
II
| 5, 23, 52, 64, 98, 105, 130, 147, 168
190, 220, 240, 249, 274, 281, 320, 329
| |
| I
II
| 6, 24, 53, 65, 97, 106, 131, 148, 169
191, 211, 231, 250, 275, 282, 301, 330
| |
| I
II
| 7, 25, 54, 66, 96, 107, 132, 149, 170
192, 212, 232, 251, 276, 283, 302, 334
| |
| I
II
| 8, 26, 55, 67, 95, 108, 133, 150, 171
193, 213, 233, 252, 277, 284, 303, 335
| |
| I
II
| 9, 27, 56, 68, 94, 109, 134, 151, 172
194, 214, 234, 253, 278, 285, 304, 336
| |
| I
II
| 10, 28, 57, 69, 93, 110, 135, 152, 173
195, 215, 235, 254, 279, 286, 305, 337
| |
| I
II
| 11, 29, 58, 70, 92, 111, 136, 153, 174
196, 216, 236, 255, 280, 287, 306, 338
| |
| I
II
| 12, 30, 59, 71, 91, 112, 137, 154, 175
197, 217, 237, 256, 264, 288, 307, 339
| |
| I
II
| 13, 31, 60, 72, 90, 113, 138, 155, 176
198, 218, 238, 257, 265, 289, 308, 340
| | Номер варианта
| Номер контрольного задания
| Номера задач, относящихся к данному заданию
| |
| I
II
| 14, 32, 41, 73, 89, 114, 139, 156, 177
199, 219, 239, 258, 266, 290, 309, 331
| |
| I
II
| 15, 33, 42, 74, 88, 115, 140, 157, 178
200, 220, 240, 259, 267, 291, 310, 332
| |
| I
II
| 16, 34, 43, 75, 87, 116, 131, 158, 179
181, 201, 221, 260, 268, 292, 311, 333
| |
| I
II
| 17, 35, 44, 76, 86, 117, 132, 159, 180
182, 202, 222, 241, 269, 293, 312, 321
| |
| I
II
| 18, 36, 45, 77, 85, 118, 133, 160, 161
183, 203, 223, 242, 270, 294, 313, 322
| |
| I
II
| 19, 37, 46, 78, 84, 119, 134, 141, 162
184, 204, 224, 243, 261, 295, 314, 323
| |
| I
II
| 20, 38, 47, 79, 83, 120, 135, 142, 163
185, 205, 225, 244, 262, 296, 315, 324
| |
| I
II
| 1, 39, 48, 80, 82, 110, 136, 143, 164
186, 206, 226, 245, 263, 297, 316, 325
| |
| I
II
| 2, 40, 49, 61, 81, 111, 137, 144, 165
187, 207, 227, 246, 271, 298, 317, 326
| |
| I
II
| 3, 24, 50, 62, 100, 112, 138, 145, 166
188, 208, 228, 247, 272, 299, 318, 327
| |
| I
II
| 4, 25, 51, 63, 99, 113, 139, 146, 167
189, 209, 229, 248, 273, 300, 319, 328
| |
| I
II
| 5, 26, 52, 64, 98, 114, 140, 147, 168
190, 210, 230, 249, 274, 281, 320, 329
|
ПРИЛОЖЕНИЕ
Таблица 1. Стандартные энтальпии образования  Н0298, кДж/моль некоторых веществ Н0298, кДж/моль некоторых веществ
| Вещество
|  Н0298, кДж/моль Н0298, кДж/моль
| Вещество
|  Н0298, кДж/моль Н0298, кДж/моль
| | С2Н2 (г)
| + 226,75
| Н2О (г)
| - 241,83
| | С2Н4 (г)
| + 52,28
| Н2О (ж)
| - 285,84
| | С2Н6 (г)
| - 84,67
| Fe2O3 (к)
| - 822,10
| | С2Н5ОН (г)
| - 235,31
| Аl2О3 (к)
| - 1669,80
| | СН4 (г)
| - 74,85
| Са(ОН)2 (к)
| - 986,50
| | NО (г)
| + 90,37
| СаС2 (к)
| - 59,83
| | N2O (г)
| + 82,01
| НСl (г)
| - 92,31
| | NH3 (г)
| - 46,19
| NН4Сl (к)
| - 315,39
| | СО2 (г)
| - 393,51
| С2Н5ОН (ж)
| -276,98
| | СО(г)
| -110,53
| Н2О2 (ж)
| -187,86
| | SO2 (г)
| -296,90
| SO3 (г)
| 395,85
|
Таблица 2. Стандартные абсолютные энтропии S0298 некоторых веществ
| Вещество
| S0298, Дж/моль · К
| Вещество
| S0298, Дж/моль · К
| | С (графит)
| 5,69
| СО (г)
| 197,91
| | Мg (к)
| 32,68
| С2Н2 (г)
| 200.82
| | Na (к)
| 51,21
| О2 (г)
| 205,03
| | S (к, ромб)
| 31,90
| Н2S (г)
| 205,64
| | ВаО (к)
| 213,80
| NO (г)
| 210,20
| | СаО (к)
| 38,07
| СО2 (г)
| 213,65
| | МgO (к)
| 61,50
| Сl2 (г)
| 222,95
| | Н2О (ж)
| 69,94
| NO2 (г)
| 240,46
| | Вещество
| S0298, Дж/моль · К
| Вещество
| S0298, Дж/моль · К
| | Н2О (г)
| 188,72
| SO2 (г)
| 248,07
| | Н2 (г)
| 130,59
| SO3 (г)
| 256,69
| | Fe3O4 (к)
| 146,19
| FeO (к)
| 60,75
| | СН4 (г)
| 186,19
| NaCl (к)
| 72,13
| | НСl (г)
| 186,68
| ВаСО3 (к)
| 112,13
| | N2 (г)
| 191,49
| СаСО3 (к)
| 91,71
| | NH3 (г)
| 192,50
| МgCO3 (к)
| 65,10
|
Таблица 3. Стандартные энергии Гиббса образования  G0298 некоторых веществ G0298 некоторых веществ
| Вещество
|  G0298, кДж/моль G0298, кДж/моль
| Вещество
|  G0298, кДж/моль G0298, кДж/моль
| | Fe (к)
|
| N2 (г)
|
| | S (к, ромб)
|
| СО2 (г)
| -394,38
| | Аl (к)
|
| СО (г)
| -137,27
| | Al2O3 (к)
| -1582,27
| СН4 (г)
| -50,79
| | ВаО (к)
| -528,40
| С2Н2 (г)
| +209,20
| | FeO (к)
| -243,30
| NO (г)
| +86, 69
| | Fe2O3 (к)
| -740,34
| NH3 (г)
| -16,48
| | Fe3O4 (к)
| -1014.20
| Н2S (г)
| -51,42
| | СаО (к)
| -604,20
| Н2О (г)
| -228,59
| | СuO (к)
| -134,26
| Н2О (ж)
| -237,19
| | МnO (к)
| -363,34
| Н2О2 (ж)
| -120,52
| | PbO (к)
| -188,20
| ВаСО3 (к)
| -1138,80
| | O2 (г)
|
| СаСО3 (к)
| -1128,75
| | Н2 (г)
|
| MgCO3 (к)
| -1012,15
| | MgO (к)
| -569,27
|
|
|
Таблица 4. Константы диссо
|



 (полиэтилен высокого давления и полиэтилен низкого давления)
(полиэтилен высокого давления и полиэтилен низкого давления) 


 ) или ионная полимеризация при небольшом давлении в присутствии катализаторов.
) или ионная полимеризация при небольшом давлении в присутствии катализаторов.

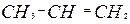


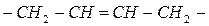




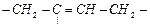















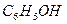 Формальдегид
Формальдегид 
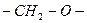


 Формальдегид
Формальдегид  - капроамид (полиамид-6, капрон)
- капроамид (полиамид-6, капрон)

 |
| 


 Гексаметилендиамин
Гексаметилендиамин

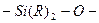 (R-ароматические и алифатические радикалы)
(R-ароматические и алифатические радикалы)

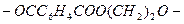
 Этиленгликоль
Этиленгликоль



 двухатомные фенолы, например дифенилолпропан.
двухатомные фенолы, например дифенилолпропан.


 \ /
\ /


 \ /
\ /
 \ /
\ /
 . Плотность вещества 19320 кг/м3.
. Плотность вещества 19320 кг/м3.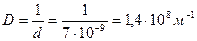

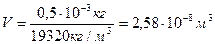


 40 мл 0,004 М раствора
40 мл 0,004 М раствора 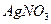 . Определить заряд частиц полученного золя и написать формулу его мицеллы. Какой электролит является стабилизатором для данного золя?
. Определить заряд частиц полученного золя и написать формулу его мицеллы. Какой электролит является стабилизатором для данного золя?
 . Для того чтобы вместо осадка
. Для того чтобы вместо осадка 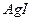 образовался коллоидный раствор, необходимо условие: один из реагентов должен быть в избытке. Рассчитаем число молей нитрата серебра и иодида калия:
образовался коллоидный раствор, необходимо условие: один из реагентов должен быть в избытке. Рассчитаем число молей нитрата серебра и иодида калия:

 >
>  следовательно,
следовательно,  и частицы золя приобретают отрицательный заряд. Противоионами являются катионы
и частицы золя приобретают отрицательный заряд. Противоионами являются катионы  . В целом мицелла нейтральна. Мицелла имеет строение:
. В целом мицелла нейтральна. Мицелла имеет строение: ,
, - гранула;
- гранула;  - потенциалопределяющие (зарядообразующие) ионы, каким будет заряд этих ионов, таким будет и заряд гранулы;
- потенциалопределяющие (зарядообразующие) ионы, каким будет заряд этих ионов, таким будет и заряд гранулы;  - адсорбционный слой – неподвижный;
- адсорбционный слой – неподвижный; 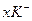 - диффузный слой, подвижный.
- диффузный слой, подвижный. . Иногда вместо порога коагуляции используют величину γ, называемую коагулирующей способностью:
. Иногда вместо порога коагуляции используют величину γ, называемую коагулирующей способностью: 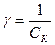 .
.



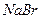 равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы?
равны соответственно 50,0; 0,8; 49,0 ммоль/л. Как относятся между собой величины коагулирующих способностей этих веществ? Укажите коагулирующие ионы. Каков знак заряда коллоидной частицы?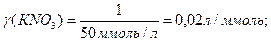


 обладает наибольшей коагулирующей способностью.
обладает наибольшей коагулирующей способностью.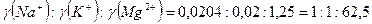 что соответствует правилу Шульце-Гарди.
что соответствует правилу Шульце-Гарди. м. Определите удельную поверхность и дисперсность аэрозоля. Плотность угля 1,8 кг/м3.
м. Определите удельную поверхность и дисперсность аэрозоля. Плотность угля 1,8 кг/м3. был получен при взаимодействии растворов
был получен при взаимодействии растворов 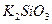 и
и 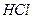 . Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду. Какой метод был использован при получении данного золя?
. Напишите формулу мицеллы золя и определите, какой из электролитов был в избытке, если противоионы в электрическом поле движутся к катоду. Какой метод был использован при получении данного золя?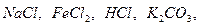
 олеат калия. Приведите формулу полученной мицеллы.
олеат калия. Приведите формулу полученной мицеллы. в открытых емкостях в них появляется муть: образуются карбонаты вследствие поглощения
в открытых емкостях в них появляется муть: образуются карбонаты вследствие поглощения  ,
,  или
или  после чего происходит интенсивное выпадение осадка. Объясните это явление, исходя из того, что частички взвеси в природной воде имеют отрицательные электрические заряды, а вводимые соли при растворении подвергаются гидролизу.
после чего происходит интенсивное выпадение осадка. Объясните это явление, исходя из того, что частички взвеси в природной воде имеют отрицательные электрические заряды, а вводимые соли при растворении подвергаются гидролизу.
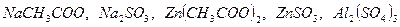 . У какого электрода будет концентрироваться каучук, если латекс поместить в сильное электрическое поле?
. У какого электрода будет концентрироваться каучук, если латекс поместить в сильное электрическое поле? для золя кремниевой кислоты, частицы которого заряжены отрицательно?
для золя кремниевой кислоты, частицы которого заряжены отрицательно? Н0298, кДж/моль некоторых веществ
Н0298, кДж/моль некоторых веществ


