
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
некоторых металлов (ряд напряжений)Содержание книги
Поиск на нашем сайте
Таблица 7. Растворимость кислот, солей, оснований в воде.
Таблица 8. Степени окисления s- и р- элементов.
Серым выделены символы неметаллов
Таблица 9. Основные классы неорганических веществ.
Таблица 10. Взаимосвязь простых веществ, оксидов, оснований и кислот (реакции солеобразования)
Таблица 11. Периодическая система элементов Д.И. Менделеева.
СПИСОК ЛИТЕРАТУРЫ
1. Артеменко А.И.«Органическая химия». – М.: Высшая школа, 2000. – 559с. 2. Васильева З.Г., Грановская А.А., Таперова А.А. Лабораторные работы по общей и неорганической химии. – М.: Химия, 1979. 3. Введение в общую химию/Под ред. Г.П. Лучинского. – М.: Высшая школа, 1980. 4. Гельфман М.И., Ковалевич О.В., Юстратов В.П. Коллоидная химия.- СПб.: Издательство «Лань», 2003. – 336 с., ил. – (Учебник для вузов) 5. Глинка Н.Л. Задачи и упражнения по общей химии. – Л.: Химия, 2000. 6. Глинка Н.Л. Общая химия. – Л.: Химия, 2004. 7. Гольбрайх З.Е. Сборник задач и упражнений по химии. – М.: Высшая школа, 2001. 8. Картушинская А.И., Лельчук Х.А., Стромберг А.Г., Сборник задач по химической термодинамике.-М.: Высшая школа, 1973. 9. Коровин Н.В. Общая химия: Учеб. для технических направ. и спец. вузов. – М.: Высшая школа, 2005. – 557 с. 10. Краткий справочник физико-химических величин под редакцией А.А Равделя А.А., Пономаревой А.М.-Л.: Химия, 1986. 11. Курс общей химии/ Под ред. Н.В. Коровина. – М.: Высшая школа, 1981. 12. Курс химии. Ч. 2, специальная для строительных вузов/ Под. Ред. В.А. Киреева. – М.: Высшая школа, 1974. 13. Левант Г.Е., Райцин Г.А. Практикум по общей химии. – М.: высшая школа, 1978. 14. Лучинский Г.П. Курс химии. – М.: Высшая школа, 1985. 15. Павлов Н.Н. Теоретические основы общей химии. – М.: Высшая школа, 1978. 16. Романцева Л. М., Лещинская З. Л., Суханова В. А. Сборник задач и упражнений по общей химии: Учебное пособие для нехим. спец. вузов/ – М.: Высшая школа, 1991.-288 с. 17. Семчиков Ю.Д. Высокомолекулярные соединения. – М.: Издательский центр «Академия», 2003. – 368 с. 18. Тугов И.И., Костыкина Г.И.«Химия и физика полимеров». – М.: Химия, 1989. – 432с. 19. Фролов В.В. Химия. – М.: Высшая школа, 1979. 20. Харин А.Н., Катаева Н.А., Харина Л.Т. Курс химии. – М.: Высшая школа, 1983. 21. «Энциклопедия полимеров» гл. ред. В.А. Каргин. – М.: Советская энциклопедия, 1972. 1-3 том.
СОДЕРЖАНИЕ КАФЕДРА ОБЩЕЙ И СПЕЦИАЛЬНОЙ ХИМИИ.. 3 ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ.. 3 ПРОГРАММА.. 5 КОНТРОЛЬНЫЕ ЗАДАНИЯ.. 12 1. Задания к контрольной работе №1. 12 1.1.Моль. Эквиваленты и мольные массы эквивалентов простых и сложных веществ. Закон эквивалентов. 12 1.2. Энергетика химических процессов. 18 (термохимические расчеты) 18 1.3. Химическое сродство. 23 1.4. Химическая кинетика. 28 1.5. Химическое равновесие. 33 1.6.Способы выражения концентрации раствора. 39 1.7. Свойства растворов. 46 1.8. Ионно – молекулярные (ионные) реакции обмена. 51 1.9. Гидролиз солей. 57 2. Задания к контрольной работе №2. 63 2.1. Окислительно – восстановительные реакции. 63 2.2. Электродные потенциалы и электродвижущие силы.. 73 2.3. Коррозия металлов. 84 2.4. Электролиз. 89 2.5. Свойства соединений s-, p-, d – элементов. 96 2.6. Жесткость воды и методы её устранения. 102 2.7. Органические соединения. Полимеры. 106 2.8. Дисперсные системы. 111 ТАБЛИЦА ВАРИАНТОВ КОНТРОЛЬНЫХ ЗАДАНИЙ.. 117 ПРИЛОЖЕНИЕ.. 124 СПИСОК ЛИТЕРАТУРЫ... 132
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 178; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.140 (0.008 с.) |

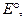
 ) при
) при 
 .
.





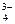
 COO
COO 




















