
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Жесткость воды и методы её устраненияСодержание книги
Поиск на нашем сайте Для ответов на контрольные вопросы рекомендуем воспользоваться литературой 5, 6, 7, 9, 11, 14, 15. Жесткость воды обусловлена присутствием в воде растворимых солей кальция и магния. Карбонатная жесткость зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Поэтому карбонатную жесткость называют также устранимой или временной. Некарбонатная жесткость вызывается присутствием в воде сульфатов (а также хлоридов) кальция и магния. Кипячением она не устраняется и поэтому называется постоянной. Сумма карбонатной и некарбонатной жесткости дает общую жесткость воды. Принято жесткость выражать молярной концентрацией эквивалентов кальция и магния (z = 2) в моль на 1 л воды или (ммоль/л). Практически при этом указывают молярную концентрацию эквивалентов раствора солей, умноженную на 1000. Зная, что мольные массы эквивалентов кальция и магния (Z=2) равны 20,04 и 12,16 соответственно, можно рассчитать жесткость по солевым концентрациям этих ионов
Так же жесткость можно определить, зная массу соли, обуславливающей жесткость воды или вещества, применяемого для устранения жесткости воды по формуле:
где Пример 1. Сколько граммов Решение: Из формулы Пример 2. Вычислите карбонатную жесткость воды, зная, что на титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 раствора Решение: Жесткость воды рассчитывают по формуле
будет в два раза меньше, чем у
Контрольные вопросы
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 476; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

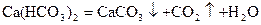

 и
и 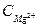
 , ммоль/л
, ммоль/л , ммоль/л
, ммоль/л - масса вещества, обуславливающего жесткость воды или применяемого для устранения жесткости воды, мг;
- масса вещества, обуславливающего жесткость воды или применяемого для устранения жесткости воды, мг;  - молярная масса эквивалента вещества;
- молярная масса эквивалента вещества; 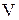 - объем воды, л.
- объем воды, л. содержится в 1000 л воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л?
содержится в 1000 л воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/л? выразим массу вещества, обуславливающего жесткость воды:
выразим массу вещества, обуславливающего жесткость воды:  , мольная масса
, мольная масса  с молярной концентрацией эквивалента 0,08 моль/л.
с молярной концентрацией эквивалента 0,08 моль/л. , тогда количество вещества
, тогда количество вещества  в соответствии с реакцией:
в соответствии с реакцией: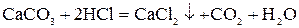
 = 0,0025 моль, тогда масса
= 0,0025 моль, тогда масса  .
. ; б)
; б)  ; в)
; в)  ? Рассмотреть случаи постоянной и временной жесткости.
? Рассмотреть случаи постоянной и временной жесткости.

 и 148 мг ионов
и 148 мг ионов 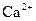 . Вычислить общую жесткость воды.
. Вычислить общую жесткость воды.
 надо прибавить к 10 л воды, чтобы устранить её карбонатную жесткость, равную 4,5 ммоль/л?
надо прибавить к 10 л воды, чтобы устранить её карбонатную жесткость, равную 4,5 ммоль/л?



