
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила расчета эквивалентного числа в конкретных ситуациях.Содержание книги
Поиск на нашем сайте 1. Для кислот эквивалентное число равно числу замещаемых в конкретной реакции ионов водорода, а для оснований - числу замещаемых гидроксид-ионов. Пример:
2. Эквивалентное число соли равно произведению количества замещаемых катионов металла на их заряд или произведению числа замещаемых анионов кислотных остатков на модуль их заряда. Пример:
3. Эквивалентное число оксида равно произведению числа атомов элемента на валентность элемента. Пример: 4. Эквивалентное число в окислительно-восстановительных реакциях определяется числом электронов, которые отдает или принимает частица восстановителя или окислителя. Пример:
3 6
Количество вещества - это число структурных элементов (атомов, молекул, ионов, эквивалентов) в системе. Единицей измерения количества вещества является моль. Моль - количество вещества системы, которое содержит столько структурных элементов (молекул, эквивалентов и др.), сколько атомов содержится в 0,012 кг изотопа углерода 12. Число структурных единиц в моле называют числом Авогадро и для практических расчетов принимают равным 6,02 · 1023. Массу одного моля вещества называют молярной массой М. Численно молярная масса равна молекулярной, но измеряется в г/моль. Например, молярная масса аммиака: Молярную массу эквивалентов вещества В (в г/моль) можно рассчитать, исходя из молярной массы вещества, по формуле:
Количество вещества эквивалентов (в моль) находят отношением массы вещества к молярной массе его эквивалента:
Количественные соотношения между эквивалентами веществ, участвующих в химической реакции, задаются законом эквивалентов: массы реагирующих друг с другом веществ, а также массы продуктов этой реакции пропорциональны молярным массам эквивалентов этих веществ. Согласно этому закону для реакции А + B = C + D должно выполняться соотношение:
где Таким образом, для взаимодействующих веществ А и В можно записать:
или подставив значение
Пример 1. Определите молярную массу эквивалентов Решение:
Ответ: Молярная масса эквивалентов Пример 2. Вычислите молярную массу эквивалентов магния, если 60 г его вытеснили из кислоты 56 л водорода (н.у.). Решение: По закону эквивалентов: Выразив количество молей эквивалентов магния через массу магния, а количество молей эквивалентов газообразного водорода через объем газа, получаем выражение: Преобразуем выражение Число эквивалентности
Ответ: Молярная масса эквивалентов магния равна 12 г/моль. Пример 3. При окислении щелочно-земельного металла массой 5г образуется оксид массой 7 г. Назовите этот металл. Решение: По закону эквивалентов:
обозначим Ответ: Определяемый металл – кальций. Контрольные вопросы 1. Определите молярные массы эквивалентов а) б) в) г) 2. Сколько молей эквивалентов содержится в а) 24,5 г б) 12,3 г 3. Рассчитайте молярную массу эквивалентов кислоты, если на нейтрализацию 0,009 кг ее израсходовано 0,008 кг гидроксида натрия. 4. Определите молярную массу двухвалентного металла, если 14,2 г оксида этого металла образуют 30,2 г сульфата металла. 5. На нейтрализацию 0,471 г фосфористой кислоты израсходовано 0,644 г КОН. Вычислите молярную массу эквивалентов кислоты. 6. Определите молярную массу эквивалентов следующих соединений: 7. При нагревании 20,06 г металла было получено 21,66 г его оксида. Найдите молярную массу эквивалентов металла, если молярная масса эквивалентов кислорода равна 8 г/моль. 8. Вычислите молярную массу эквивалентов цинка, если 1,196 г этого металла вытеснили из кислоты 438 мл водорода, измеренного при 17 °С и давлении 1 атм. 9. Для растворения 16,8 г металла потребовалось 14,7 г серной кислоты. Определить молярную массу эквивалентов металла и объем выделившегося водорода (н. у.). 10. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить молярные массы эквивалентов металла и его оксида. 11. Масса 1 л кислорода равна 1,4 г. Сколько литров кислорода расходуется при сгорании 21,0 г магния, число эквивалентности которого равно 2? 12. На нейтрализацию 2,45 г кислоты идет 2,00 г гидроксида натрия. Определить молярную массу эквивалентов кислоты. 13. В каком количестве NaOH содержится столько же молей эквивалентов, сколько в 140 г КОН? 14. В каком количестве 15. 0,493 гхлорида некоторого металла после обработки нитратом серебра образовали 0,861 г AgCl. Вычислить молярную массу эквивалентов металла. 16. Из 0,432 гметалла образовали 0,574 гего хлорида. Вычислить молярную массу эквивалентов металла, приняв молярную массу эквивалентов хлора равной 35,5 г/моль. 17. При пропускании сероводорода через раствор, содержащий 2,98 г хлорида некоторого одновалентного металла, образуется 2,2 г его сульфида. Вычислите молярную массу эквивалентов металла. 18. При сгорании трехвалентного металла массой 11,2 г образовался оксид массой 16 г. Какой был взят металл? 19. Сколько литров в) 100 г карбоната кальция? 20. Сколько молей эквивалентов оксида цинка получится при взаимодействии цинка с кислородом объемом 5,6 л (н.у.).
|
||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 772; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |


 ;
; 

 ;
; 
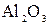
 .
.

 1 2
1 2 

 ;
;  ;
;  ;
;  .
.


 ,
, – количество молей эквивалентов соответствующего вещества.
– количество молей эквивалентов соответствующего вещества.
 , получим
, получим ;
; 
 .
. .
. (число катионов кальция) ∙ 2(заряд катиона) = 2
(число катионов кальция) ∙ 2(заряд катиона) = 2 .
.
 .
.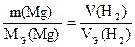
 ;
; ;
; 


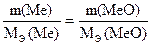
 ,
, 
 ;
;  ;
;
 ; решив уравнение, получаем
; решив уравнение, получаем 
 ; для двухвалентного щелочно-земельного металла Z(Ме)=2;
; для двухвалентного щелочно-земельного металла Z(Ме)=2; 
 г/моль
г/моль и
и  в следующих реакциях:
в следующих реакциях:



 ; в) 150 г
; в) 150 г  ; д) 79 г
; д) 79 г 

 содержится столько же молей эквивалентов, сколько в 156 г
содержится столько же молей эквивалентов, сколько в 156 г  ?
? (при н.у.) надо пропустить через раствор
(при н.у.) надо пропустить через раствор  , чтобы получить: а) 7 молей эквивалентов карбоната кальция; б) 7 молей карбоната кальция;
, чтобы получить: а) 7 молей эквивалентов карбоната кальция; б) 7 молей карбоната кальция;


