
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярные и ионно-молекулярные уравнения реакцийСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте 226. Какое из веществ: NaCl, NiSO4, Be(OH)2, KHCO3 - взаимодействует с раствором гидроксида натрия. Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 227. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Ba2+ + SO б) Be(OH)2 + 2ОН– = ВеО в) СН3СОО– + Н+ = СН3СООН. 228. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) FeCl3 и КОН; б) NiSO4 и (NH4)2S; в) MgCO3 и HNO3. 229. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) H2SO4 и Ba(OH)2; б) НСl и СН3СООNa; в) FeCl3 и NН4OH. 230. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Ag+ + Cl– = AgCl; б) Zn2+ + H2S = ZnS + 2H+; в) hCO 231. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) СdS и НСl; б) Cr(OH)3 и NaOH; в) Ba(OH)2 и CoCl2. 232. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) H+ + NO б) Fe(OH)3 + 3H+= Fe3+ + 3H2O; в) Cd2+ + 2OH– = Сd(OH)2. 233. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Na3PO4 и CaСl2; б) BaCl2 и K2CO3; в) Zn(OH)2 и KOH. 234. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Be(OH)2 и NaOH; б) HNO3 и Cu(OH)2; в) ZnOHNO3 и HNO3. 235. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Pb2+ + 2J– = PbJ2; б) CaCO3 + 2H+ = Ca2+ + H2O + CO2; в) Al(OH)3 + OH– = AlO 236. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) AgNO3 и K2CrO4; б) KJ и Pb(NO3)2; в) CdSO4 и Na2S. 237. Какое из веществ: KHCO3, СН3СООН, NiSO4, Na2S - взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. 238. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) Sn(OH)2 и HCl; б) BeSO4 и KOH; в) NH4Cl и Ba(OH)2. 239. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Cu2+ + S2– = CuS; б) SiO 240. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) СuSO4 и H2S; б) BaSO3 и HNO3; в) FeCl3 и KOH. 241. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) KHCO3 и H2SO4; б) NaOH и Zn(OH)2; в) CaCl2 и AgNO3. 242. Какое из веществ: Al(OH)3; H2SO4; Ba(OH)2 - будет взаимодействовать с гидроксидом калия? Выразите эти реакции молекулярными и ионно-молекулярными уравнениями. 243. Составьте по три молекулярных уравнения реакций, которые выражаются ионно-молекулярными уравнениями: а) Mg2+ + CO б) H+ + OH– = H2O. 244. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) K2S и HCl; б) FeSO4 и (NH4)2s; в) Cr(OH)3 и KOH. 245. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия в растворах между: а) NaHCO3 и NaOH; б) FeSO4 и (NH4)2s; в) Cr(OH)3 и KOH. 246. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями: а) Со2+ + H2S = CoS + 2H+; б) Ca2+ + CO в) 3Li+ + PO 247. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями: а) НСО б) Cd2+ + S2– = CdS; в) Pb2+ + 2J– = PbJ2. 248. К каждому из веществ: Cr(OH)3, Ba(OH)2, FeCl3 - прибавили раствор едкого кали. В каких случаях произошли реакции? Выразите их молекулярными и ионными уравнениями. 249. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями: а) Pb(OH)2 + 2OH– = PbO б) Cu2+ + S2– = CuS; в) SiO 250. Составьте молекулярные уравнения реакций, которые выражаются ионными уравнениями: а) НСО б) Be(OH)2 + OH– = BeO в) Al(OH)3 + 3H+ = Al3+ + 3H2O. ГИДРОЛИЗ СОЛЕЙ 251. При смешивании растворов Al2(SO4)3 и Na2S в осадок выпадает гидроокись алюминия Al(OH)3. Объяснить причину и привести соответствующие уравнения реакций. 252. При сильном разбавлении водой раствора Bi(NO3)3 выделяется обильный белый осадок, представляющий собой смесь основных солей висмута (дигидроксонитрат и гидроксодинитрат висмута). Написать уравнения реакций образования указанных солей. В какую сторону сместится рН среды в результате гидролиза нитрата висмута? 253. Гидролиз раствора FeCl3 при нагревании идет ступенчато и заканчивается образованием осадка Fe(OH)3. Представить уравнениями все три ступени этого процесса (3 уравнения) и вывести суммарное уравнение. 254. При смешении растворов Al2(SO4)3 и Na2CO3 в осадок выпадает Al(OH)3. Указать причину образования осадка и составить соответствующие уравнения. 255. При взаимодействии ацетата свинца с карбонатом натрия в водной среде получился осадок состава (PbOH)2CO3 и PbCO3. Составить уравнение. 256. При смешении концентрированных растворов FeCl3 и Na2CO3 образуется Fe(OH)3 и выделяется CO2. Представить ионные уравнения соответствующих реакций. 257. В какую сторону сместится равновесие гидролиза КСN, если к раствору прибавить: а) щелочь; б) кислоту? Напишите уравнение гидролиза в молекулярном и ионном виде. 258. Подберите по два уравнения в молекулярном виде к каждому из кратких ионных уравнений: а) Fe3+ + 2H2O↔Fe(OH) б) (CO3)2– + H2O↔(HCO3)– + oh–; в) (NH4)+ + H2O↔NH4OH + H+. 259. К раствору FeCl3 добавили следующие вещества: а) Hcl; б) koh; в) ZnCl2; г) Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 260. К раствору Na2CO3 добавили следующие вещества: а) Hcl; б) NaOH; в) Cu(NO3)2; г) K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнение гидролиза соответствующих солей. 261. К раствору Al2(SO4)3 добавили следующие вещества: а) H2SO4; б) KOH; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. 262. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 263. Какая из двух солей при равных условиях в большей степени подвергается гидролизу: NaCN или NaClO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. 264. Составить ионные и молекулярные уравнения реакций, протекающих при смешивании растворов: Cr2(SO4)3 и K2CO3, FeCl3 и Na2CO3, FeCl3 и NaCN. Иметь в виду, что в каждой реакции гидролиз обеих солей доходит до конца. 265. Составить молекулярное и ионное уравнения реакций, протекающей при смешивании растворов FeCl3 и NaC2H3O2, считая, что гидролиз FeCl3 идет до образования основной соли FeOH(C2H3O2)2. 266. Указать характер среды растворов солей: K2SiO3, NaBr, KClO3, Cu(NO3)2. 267. Составить молекулярные и ионные уравнения гидролиза солей: CaS, Na2SiO3, ZnSO4, CrCl3, Fe2(SO4)3. 268. При смешивании растворов сернокислого алюминия и соды Na2СO3 гидролиз обеих солей доходит до конца, вследствие чего реакция протекает по ионной схеме Al3+ + CO
H2O CO2 Составить ионное и молекулярное уравнения реакции, имея в виду, что при взаимодействии ионов число их находится в обратном отношении к валентности. 269. При смешивании растворов CrCl3 и (NH4)2S гидролиз обеих солей доходит до конца Cr3+ + HOH S2– + HOH Составить ионные и молекулярные уравнения реакции гидролиза обеих солей при их смешивании, имея в виду, что образующиеся при гидролизе ионы Н+ и ОН– нейтрализуют друг друга. 270. При смешивании растворов Pb(C2H3O2)2 и Na2CO3 выпадает осадок состава (PbOH)2CO3 и PbCO3. Составить ионное и молекулярное уравнения реакции. 271. Какие из пар солей в водных растворах взаимно усиливают гидролиз: Cr2(SO4)3 и K2S; Al(NO3)2 и ZnCl2; Al(NO3)3 и Na2S. Написать уравнения реакций, мотивирующие ответ. 272. Почему растворы К2СО3 и NaCN имеют щелочную реакцию, а растворы NH4Cl и ZnCl2 - кислую? Ответ подтвердите, составив уравнения гидролиза в молекулярном и ионном виде. 273. При сливании растворов CrCl3 и Na2CO3 образуется осадок гидроксида хрома (III). Объясните причину этого явления и напишите соответствующие уравнения в молекулярном и ионном виде. 274. Составьте ионно-молекулярное и молекулярное уравнения совместного гидролиза, происходящего при смешивании растворов K2S и CrCl3. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. 275. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение рН (>7<) имеют растворы этих солей?
ВАРИАНТЫ КОНТРОЛЬНЫХ РАБОТ
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 1. Глинка, Н. Л. Общая химия / Н. Л. Глинка; под ред. А. И. Ермакова. - Изд. 30-е, испр.. - М.: Интеграл-Пресс, 2006. - 727 с. 2. Глинка, Н. Л. Задачи и упражнения по общей химии: учеб. пособие для нехим. специальностей вузов / Н. Л. Глинка, под ред. В. А. Рабиновича, Х. М. Рубиной. - Изд. стер.. - М.: Интеграл-Пресс, 2006. - 240 с. 3. Коровин, Н.В. Общая химия: учебник для вузов / Н.В. Коровин. - М.: Высш. шк., 2005. - 557 с. 4. Артеменко, А.И. Органическая химия: учебник для строит. специальностей вузов / А.И. Артеменко. – Изд. 5 –е, испр. – М.: Высш. шк., 2002. – 559с. 5. Задачи упражнения по общей химии: учебное пособие для вузов по техническим специальностям / сост.: Б.И. Адамсон, О.Н. Гончарук, В.К. Камышова [и др.]; под ред. Н.В. Коровина.- М.: Высш.шк., 2004.- 255 с. ОГЛАВЛЕНИЕ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 735; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 = BaSO4;
= BaSO4; + 2Н2О;
+ 2Н2О; + H+ = H2O + CO2.
+ H+ = H2O + CO2. = HNO2;
= HNO2; + 2H+ = H2SiO3.
+ 2H+ = H2SiO3.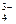 = Li3PO4.
= Li3PO4.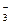 + Н+ = Н2О + СО2;
+ Н+ = Н2О + СО2; + 2H2O;
+ 2H2O; + 2H+;
+ 2H+; Al(OH)3 + H2CO3
Al(OH)3 + H2CO3




