
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергетика химически процессовСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
101. Определите количество теплоты, выделяющейся при взаимодействии 50 г Р2О5 с водой по реакции Р2О5 + Н2О = 2НРО3, если тепловые эффекты реакции равны: 2Р + 5/2О2 = Р2О5; ∆Нр =–1549,0 кДж; 2P + Н2 + 3О2 = 2НРО3; ∆Нр =–1964,8 кДж. 102. Процесс гашения оксида кальция представлен следующим термохимическим уравнением: СаО + Н2О = Са(ОН)2 + 16 ккал. Сколько теплоты выделится при гашении 1 т извести, содержащей 20% посторонних примесей. 103. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений: FeO(к) + СО(г) = Fe(к) + CO2(г); ∆Н=–13,18 кДж; СО(г) + 1/2О2(г) = СО2(г); ∆Н=–283 кДж; Н2(г) + 1/2О2(г) = H2O(г); ∆Н=–241,83 кДж. 104. Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений: Ca(к) + 1/2О2(г) = СаО(к); ∆Н=–635,6 кДж; Н2(г) + 1/2О2(г) = Н2О(ж); ∆Н=–285,84 кДж; СаО(к) + Н2О(ж) = Са(ОН)2(к); ∆Н=–65,06 кДж. 105. Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений: Н2(г) + 1/2О2(г) = Н2О(ж); ∆Н=–285,84 кДж; С(к) + О2(г) = СО2(г); ∆Н=–393,51 кДж; СН4(г) + 2О2(г) = 2Н2О(ж) + СО2(г); ∆Н=–890,31 кДж. 106. Углерод аморфного угля сгорает по термохимическому уравнению С + О2 = СО2 + 97,8 ккал (409,2 кДж). Сколько тепла выделится при сгорании 1 т кокса, содержащего 12% негорючих примесей? 107. Горение ацетилена выражается уравнением: 2С2Н2 + 5О2 = 4СО2 + 2Н2О. Вычислить величину ∆Н298, если известно, что при сгорании 1л ацетилена выделяется 13,88 ккал (58,07 кДж) тепла. 108. Вычислить теплоту сгорания ацетилена С2Н2 + 2 1/2О2 = 2СО2 + Н2О(Ж). Вычислить, сколько тепла выделится при сгорании: а) 1 м3 ацетилена, взятого при нормальных условиях; б) 20 кг ацетилена. 109. Вычислить тепловой эффект реакции восстановления хрома алюминием: Cr2O3 + 2Al = 2Cr + Al2O3. Сколько тепла выделится, если для реакции взять 1 кг исходной смеси? Ответ выразить в килоджоулях. 110. Вычислить тепловой эффект образования 1 т чистого карбида кальция СаС2: СаО + 3С = СаС2 + СО Теплота образования СаС2 равна 15 ккал/моль (62,76 кДж/моль). 111. Сколько килоджоулей выделится при сгорании 1 кг октана С8Н18? Теплота образования октана 49,82 ккал/моль (воду в продуктах сгорания считать парообразной)? 112. Вычислить стандартную энтальпию образования кристаллического оксида железа (III) по известным стандартным энтальпиям реакций: 1) Fe2O3 (Т) + 3CO (Г) = 2Fe (Т) + 3CO2 (Г), ∆Н0 = –6,74 ккал; 2) С (ГРАФ) + О2 (Г) = СО2 (Г), ∆Н0 = –94,1 ккал; 3) С (ГРАФ) + 1/2О2 (Г) = СО (Г), ∆Н0 = –26,42 ккал. 113. Вычислить стандартную энтальпию образования кристаллического сульфата цинка на основании следующих данных: 1) ZnSO4 (Т) = ZnO (Т) + SO3 (Г), ∆H 2) 2ZnS (Т) + 3O2 (Г) = 2ZnO (Т) + 2SO2 (Г), ∆H 114. Вычислите ∆H NH3 (Г) + HСl (Г)= NH4Cl (К), ∆H 115. При растворении 16 г СаС2 в воде выделяется 31,3 кДж теплоты. Определите стандартную теплоту образования Са(ОН)2. 116. Определите ∆H 2Fe + Al2O3 = Fe2O3 + 2Al на каждые 80 г Fe2O3 поглощается 426,5 кДж теплоты. 117. Тепловой эффект реакции SO2 (Г) + 2H2S (Г) = 3S (ромб) + 2Н2О (Ж) равен –234,50 кДж. Определите стандартную теплоту образования Н2S. 118. При получении азотной кислоты из KNO3 протекают следующие реакции: KNO3 (К) + H2SO4 (P) = KHSO4 (К) + HNO3(Р) (а), 2KNO3 (К) + H2SO4 (P) = K2SO4 (К) + 2HNO3 (Р) (б). Сколько теплоты выделяется (или поглощается) при получении 1 кг азотной кислоты. если 80% ее образуется по реакции (а), ∆H 119. Разложение гремучей ртути при взрыве идет по уравнению Hg(ONC)2 = Hg + 2CO + N2, ∆H 120. Вычислите количество теплоты, которое выделяется при сгорании 20 л диборана В2Н6 (н.у.), если ∆H 121. Окисление аммиака протекает по уравнению 4NH3 (Г) + 3O2 (Г) = 2N2 + 6H2O (Ж), ∆H 122. Рассчитайте ∆H 2ZnS + 3O2 = 2ZnO + 2SO2, ∆H 2SO2 + O2 = SO3, ∆H ZnSO4 = ZnO + SO3, ∆H 123. Используя значение ∆H PbO2 + CO = PbO + CO2 124. Вычислить стандартную энтальпию образования кристаллического среднего фосфата кальция, если известно, что при сгорании 12 г кальция выделяется 45,57 ккал, при сгорании 6,2 г фосфора - –37 ккал, а при взаимодействии 168 г оксида кальция с 142 г фосфорного ангидрида - –160,5 ккал. 125. Рассчитайте тепловой эффект реакции СН4 (Г) + С12 (Г) = СН3С1 (Г) + НС1(Г), если известны тепловые эффекты реакций: 1) СН4 + 2О2 = СО2 + 2Н2О, ∆H 2) 2СН3С1 (Г) + 3О2 (Г) = 2СО2 (Г) + 2Н2О (Ж)+ 2НС1, ∆H 3) 2Н2О (Г) = 2Н2О (Ж), ∆H 4) Н2 (Г) + С12 (Г) = 2НС1(Ж), ∆H
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 783; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.254.177 (0.007 с.) |

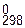 = +58,27 ккал;
= +58,27 ккал; = –133,90 кДж/моль.
= –133,90 кДж/моль.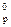 = –364,2 кДж. Определите объем выделившихся газов (н.у.) и количество теплоты, выделившейся при взрыве 1,5 кг Hg(ONC)2.
= –364,2 кДж. Определите объем выделившихся газов (н.у.) и количество теплоты, выделившейся при взрыве 1,5 кг Hg(ONC)2.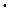 Н2О, если теплота растворения NH3 (Г) в воде равна –34,65 кДж.
Н2О, если теплота растворения NH3 (Г) в воде равна –34,65 кДж.


