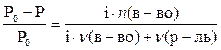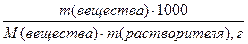Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коллигативные свойства растворовСодержание книги
Поиск на нашем сайте
План 5.1. Первый закон Рауля. 5.2. Эбулиоскопический закон Рауля. 5.3. Криоскопический закон Рауля. 5.4. Осмос. Осмотическое давление.
Коллигативными (общими) называются свойства растворов, зависящие только от их концентрации, точнее от соотношения числа частиц растворителя и растворенного вещества. Коллигативные свойства не зависят от природы веществ. Важнейшими коллигативными свойствами растворов являются: 1) понижение давления пара над раствором; 2) повышение температуры кипения раствора; 3) понижение температуры замерзания раствора; 4) осмос и осмотическое давление. Франсуа Мари Рауль, работавший в университете в Гренобле, был первым ученым-экспериментатором, сделавшим достаточно точные измерения, позволившие описать влияние растворенного вещества на физические свойства растворителя.
Первый закон Рауля
Первый закон Рауля: давление пара над раствором нелетучего вещества меньше давления пара над чистым растворителем. Это явление объясняется тем, что нелетучее растворенное вещество связывает часть молекул растворителя в виде сольватов (гидратов), тормозя процесс испарения. Математическое описание первого закона Рауля для бинарной системы зависит от того электролитом или неэлектролитом является растворенное вещество: (а) для неэлектролитов
где ро — давление насыщенного пара над чистым растворителем, P — давление пара над раствором нелетучего вещества, ν (в-во) – химическое количество растворенного вещества, моль. ν (р-ль) — химическое количество растворителя, моль. Р0-Р — относительное понижение давления пара над раствором; (б) для электролитов
где i — изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы. P — давление пара над раствором нелетучего вещества, ν (в-во) — химическое количество растворенного вещества, моль. ν (р-ль) — химическое количество растворителя, моль. Р0-Р — относительное понижение давления пара над раствором;
Эбулиоскопический закон Рауля
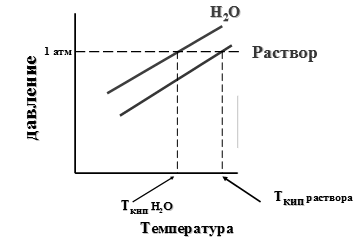
Эбулиоскопический закон Рауля: раствор нелетучего вещества кипит при более высокой температуре, чем чистый растворитель. Температура кипения (Ткип) — это температура, при которой давление пара над жидкостью равно атмосферному давлению (рисунок 7).
Рисунок 7 — Давление водяного пара над водой и раствором нелетучего вещества
Математическое описание эбулиоскопического закона: (а) для неэлектролитов: DТкип = Е·Cm, где DТкип = Tкип(р-р) - Tкип(р-ль) Сm — моляльная концентрация раствора, моль/кг Е — эбулиоскопическая константа растворителя; Е (Н2О) = 0,52. Сm= (б) для электролитов: DТкип = i·Е·Cm где i — изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы DТкип = Tкип(р-р) - Tкип(р-ль) Сm — моляльная концентрация раствора, моль/кг Е — эбулиоскопическая константа растворителя.
Криоскопический закон Рауля
Криоскопический закон Рауля: раствор нелетучего вещества замерзает при более низкой температуре, чем чистый растворитель. Температура замерзания (Тзам) — это температура, при которой давление пара над жидкостью равно давлению над твердым растворителем. Математическое описание криоскопического закона: (а) для неэлектролитов: DТзам = К·Cm, где DТзам = Tзам(р-ль) - Tзам(р-р). Для плазмы крови человека DТзам = 0,56º, а для плазмы животных DТзам = 0,58º. К — криоскопическая константа растворителя; К (Н2О) = 1,86. Сm — моляльная концентрация раствора, моль/кг (б) для электролитов: DТзам = i·К·Cm, где DТзам = Tзам(р-ль) - Tзам(р-р), К — криоскопическая константа растворителя; Сm — моляльная концентрация раствора, моль/кг i — изотонический коэффициент (коэффициент Вант-Гоффа), характеризующий диссоциацию электролита на ионы Эбулиоскопия и криоскопия — это методы, позволяющие экспериментально определить молярные массы растворенных веществ, а также некоторые другие характеристики растворов. Определение молярной массы лекарственных препаратов криоскопическим методом широко применяется в фармакопейных анализах.
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1038; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.136.18.192 (0.006 с.) |