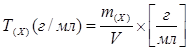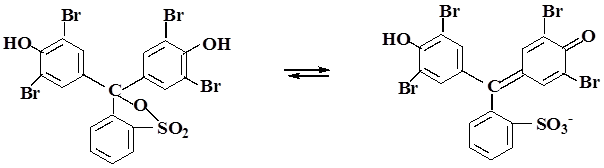Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Результаты приготовленного титрованного раствора
Титриметричекий анализ применяется для количественного определения многих лекарственных веществ. Этот метод основан на точном измерении количества реактива, израсходованного на реакцию с определяемым веществом. Для целей титриметрического анализа используют титрованные растворы. Титрованный, стандартный или рабочий раствор – это раствор, с точно известной концентрацией. Используется для количественного анализа лекарственных веществ. Согласно ГФ XII концентрацию титрованных растворов выражают молярной или нормальной концентрацией. Титрованный раствор, содержащий 1 моль вещества в 1 литре раствора, называют молярной концентрацией (С(X)). Единица молярной концентрации – моль/л. Например: С(HCI) = 0,1 моль/лHCI. Титрованный раствор, содержащий 1 моль эквивалента вещества в 1 литре раствора, называют молярной концентрацией эквивалента (нормальной концентрацией) (С(1/zH2SO4). Единица молярной концентрации эквивалента – моль эквивалентов/л (обозначается – н.) Например:(С(1/zH2SO4). = 1 н. H2SO4. Для проведения расчетов в титриметрический анализ вводят понятия эквивалент и фактор эквивалентности. Эквивалентом вещества называют реальную или условную частицу вещества, которая в данной реакции реагирует с одним атомом или ионом водорода, или одним электроном. Фактором эквивалентности называют число, показывающее, какая часть реальной частицы вещества эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Молярной массой эквивалента вещества называют величину, равную произведению фактора эквивалентности на молярную массу вещества (Э(Х)). Единица молярной массы эквивалента вещества – г/моль. Э (Х) (г/моль) = fэкв(Х)реакции х М(Х)(г/моль) где: Э(Х) - молярная масса эквивалента, г/моль; fэкв(Х)реакции - фактор эквивалентности вещества Х в химической реакции; М(Х) – молярная масса вещества Х, г/моль. Молярная масса эквивалента вещества зависит от реакции, в которой это вещество участвует. Титр раствора - это масса растворенного вещества, содержащая в одном миллилитре раствора.
Титр рассчитывают до 4-х значащих цифр. Например, T(H2SO4) = 0, 004904 г/мл. Это значит, что в 1 мл раствора содержится 0,004904 гH2SO4. Титр раствора по определяемому веществу – это масса определяемого вещества, взаимодействующая с одним миллилитром титранта.
В зависимости от способа выражения концентрации титрованного раствора титр по определяемому веществу рассчитывают по формулам: 1. Если концентрация титрованного раствора выражена молярной концентрацией
2. Если концентрация титрованного раствора выражена молярной концентрацией эквивалента
где: С(Т) – молярная концентрация титрованного раствора (моль/л); М.м.(х) – молекулярная масса определяемого вещества (г/моль); С1/z(Т) – молярная концентрация титрованного раствора, выраженная молярной концентрацией эквивалента (моль·экв./л); Э(Х) – молярная масса эквивалента определяемого вещества (г/моль); fэкв(Х)реак. - фактор эквивалентности определяемого вещества в химической реакции; 1000 – коэффициент перевода величины концентрации из размерности моль/л в размерность - моль/мл. Титр по определяемому веществу используется при расчете · массы определяемого вещества, если известен объем титранта · предварительного объема титранта, если известна масса определяемого вещества. Титрованные растворы, согласно ГФ XI готовят двумя способами: Способ 1 - по точной массе химически чистого вещества.
где: m - масса навески химически чистого вещества, г; Э (X) - молярная масса эквивалента химически чистого вещества, г/моль; V - объем раствора, пошедшего на титрование массы вещества, мл; 1000 - количество миллилитров в 1 литре раствора. Способ 2 - по титрованному раствору известной концентрации.
С (Х) (моль/л) = С(Х0)(моль/л) х V0 (мл) / V (мл)
где: С(Х0)(моль/л) – молярная концентрация раствора вещества, по которому устанавливается титр, моль/л; V0 - объем раствора, по которому устанавливают титр, мл; V - объем раствора, молярную концентрацию которого устанавливают, мл. Для приготовленных титрованных растворов вычисляют поправочный коэффициент (К), представляющий собой отношение реально полученной концентрации тированного раствора (С (1/z Х) практ.) к теоретически заданной концентрации (С (1/z Х)теор.):
Поправочный коэффициент безразмерная величина. Он показывает, во сколько раз концентрация приготовленного раствора больше или меньше заданной концентрации. Коэффициент поправки должен находиться в пределах от 0,98 до 1,02. При отклонении величины К от указанных пределов титрованные растворы необходимо соответственно укреплять или разбавлять. В случае необходимости разбавления титрованного раствора (К>1,02) из рассчитанной величины К вычитают 1,0 и полученную разность умножают на объем приготовленного раствора, в мл (V). Полученный результат соответствует количеству растворителя, в мл, которое необходимо прибавить к приготовленному раствору для доведения К до требуемого значения: Хмл = (К - 1,0)·V Для укрепления титрованного раствора (К<0,98) из 1,0 вычитают рассчитанную величину К и полученную разность умножают на массу исходного вещества (m), взятую для приготовления необходимого объема титрованного раствора: Xr = (l,0 - K)·m После добавления рассчитанного количества растворителя или исходного вещества проводят повторное определение поправочного коэффициента. При соответствии К требованиям ГФ XII титрованный раствор может быть использован в титриметрическом анализе. Индикаторы - химические вещества, которые в титриметрическом анализе позволяют установить (визуальным или инструментальным методом), что к титруемому веществу прибавлено эквивалентное количество титранта. В зависимости от химических реакций, которые лежат в основе титриметрических методов различают индикаторы: кислотно-основные (для водных и неводных сред); металлохромные (для комплексонометрии); адсорбционные (образующие осадки); окислительно-восстановительные. Индикаторные смеси и водные 0,4% растворы индикаторов готовят из соответствующих химических веществ классификации «х.ч.» и «ч.д.а.». Для приготовления раствора массу соответствующего индикатора, взятую с точностью до 0,001 г, растворяют в мерной колбе. Если готовят раствор в 0,02 М растворе гидроксида натрия, то навеску индикатора предварительно растирают в ступке с указанным раствором, а затем переносят в мерную колбу. При приготовлении индикаторной смеси навеску индикатора растирают и перемешивают в ступке с вспомогательным веществом. Готовят индикаторные смеси и растворы индикаторов в вытяжном шкафу с использованием индивидуальных средств защиты (респираторы, защитные очки, резиновые перчатки). Индикаторы, индикаторные смеси и растворы индикаторов хранят в защищенном от света месте. Индикаторные растворы и растворы смешанных индикаторов хранят в банках или флаконах оранжевого стекла. Химические формулы индикаторов приведены в приложении.
Бромтимоловый синий
Желтый Синий РН 6,0 – 7,6
Бромфеноловый синий
Желтый Синий РН 3,0 – 4,6
|
||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 516; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |