
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кондуктометрическое титрование.Содержание книги
Поиск на нашем сайте
Под кондуктометрическим титрованием понимают такой метод количественного электрообъемного анализа, при котором точку эквивалентности определяют по электропроводности раствора. Такой метод титрования позволяют довольно точно определить малые концентрации вещества, так как именно для них электропроводность сильно зависит от концентрации. Электропроводность – величина, обратная сопротивлению – пропорциональна общей концентрации катионов и анионов, их валентности и их подвижности. Подвижность иона зависит главным образом от его размера (от диаметра гидратированного иона) и от вязкости растворителя. Для большинства ионов подвижности мало различаются и в водных растворах равны около 50; от этой величины значительно отличаются подвижность ионов ОН- - 180 и Н+ - 320. Растворы электролитов являются проводниками второго рода: электрический ток в них переносится ионами, образующимися в растворе в результате диссоциации растворенного вещества. Способность растворов проводить электрический ток характеризуется обычно сопротивлением или электропроводностью. Электропроводностью проводника (L) называется величина, обратная сопротивлению (R):
Сопротивление проводника (R) зависит то его длины (
где r - удельное сопротивление. Отсюда
Величина c [Ом-1, см-1]. Величина удельной электропроводности зависит от числа ионов в единице объема (концентрации), скорости их перемещения и переносимого каждым ионом заряда. Эта зависимость выражается уравнением:
где а – степень диссоциации; С – концентрация (г.экв/л); F- число Фарадея (количество электричества, необходимое для выделения 1 г-эквивалента вещества); Изменение электропроводности раствора при его титровании происходит как за счет изменения концентрации ионов, так и за счет замены ионов, имеющих одну подвижность, ионами с другой подвижностью. Таким способом можно титровать щелочь кислотой (например, NaOH соляной кислотой) (Na+ + OH-) + (H+ + Cl-) = Na+ + Cl- + H2O. При этой реакции ион гидроксила связывается ионом водорода в практически недиссоциированную воду. Едкий натр, кроме катионов Na+, остающихся при реакции неизменными, содержит подвижные ионы гидроксила. Гидроксильные ионы при прибавлении соляной кислоты постепенно исчезают, соединяясь с водородными катионами, и замещаются медленно передвигающимися анионами Cl-, вследствие чего электропроводность постепенно уменьшается. Как только количества щелочи и кислоты станут эквивалентными, прибавляемая в дальнейшем кислота перестанет нейтрализоваться, и быстро движущиеся катионы водорода, увеличиваясь в концентрации, будут увеличивать электропроводность. В нейтральной точке, поэтому величина электропроводности имеет минимум, следовательно, последний как раз и показывает конец титрования. Если титруется малодиссоциированное соединение, то электропроводность раствора возрастает с самого начала. Обычно изменения электропроводности выражается двумя прямыми, пересекающимися в точке эквивалентности. При кондуктометрическом титровании точка эквивалентности определяется обычно с точностью в 0,5 – 1 %. Изменение температуры сильно влияет на электропроводность (25% на 10), поэтому во время титрования необходимо поддерживать постоянную температуру. Метод измерения электропроводности нашел применение в объемном анализе, так называемом кондуктометрическом титровании. Он с успехом применяется в том случае, когда исследуемые растворы являются окрашенными, мутными или содержат взвешенные частицы, когда между анализируемым и титрующим растворами могут протекать обменные ионные или окислительно-восстановительные реакции, в результате которых изменяется проводящая способность раствора. Своеобразным индикатором в этом методе является изменение электропроводности титрования. Таким образом, эквивалентную точку при кондуктометрическом титровании определяют по изменению электропроводности. Обычно изменение электропроводности в зависимости от количества прибавляемого реагента наносят на график и по точке резкого излома кривой определяют эквивалентную точку. Титрование проводят в сосуде различной конструкции, в которой погружены электроды. В случае изучения реакции нейтрализации для титрования берется 10 мл кислоты (сильной или слабой, или смесь сильной и слабой кислот), которая разбавляется таким количеством воды, чтобы электроды были полностью погружены в раствор. Щелочь из бюретки приливается постепенно, сначала по 1 мл (до 6-7 мл), затем 0,5, 0,1 мл; каждый раз содержимое сосуда перемешивается, и с помощью кондуктометра марки ОК 102/1 измеряется электропроводность раствора. Для более наглядной картины конца титрования приливается некоторое избыточное количество щелочи.
Экспериментальная часть Для выполнения кондуктометрического титрования раствора едкого натра соляной кислотой в сосуд отмеривают (пипеткой или бюреткой) определенное количество титруемой щелочи и доливают воды настолько, чтобы электрод был полностью погружен в раствор. Затем, пустив в ход мешалку, передвигают подвижной контакт к середине и вводят в реостат R такое сопротивление, которое дало бы минимум тока. Более точно минимум тока достигается передвижением контакта по мостику. Деление мостика, соответствующее минимуму тока, записывают. Затем приливают из бюретки 1 мл кислоты. Тот час же замечается усиление тока, и тогда опять с помощью подвижного контакта добиваются нового минимума тока и вновь записывают показания мостика. Так поступают и дальше. Сперва после каждой добавленной порции кислоты для достижения минимума тока приходится передвигать подвижной контакт все время в одну сторону, например, вправо, затем около точки эквивалентности после прибавки кислоты направление передвижения контакта приходится менять в обратную сторону. После изменения направления передвижения контакта достаточно для проверки прибавить только несколько миллилитров кислоты и опыт можно закончить. При опыте необходимо, чтобы электроды были хорошо укреплены и температура, по возможности, держалась бы постоянной. Результаты измерений затем наносят на график. При этом на ось абсцисс наносят миллилитры HCl, а на ось ординат – электропроводность раствора
Рис. 11. Кривая кондуктометрического Рис. 12. Кривые кондуктометрического титрования едкого натра соляной титрования соляной и уксусной кислотой. кислот в смеси. 1- 0,02 н HCl + 0,02 н CH3COOH титруется 0,6 н NaOH; 2- 0,1 н HCl + 0,1 н CH3COOH титруется 1,0 н NaOH.
одной точке. Если из точки пересечения этих кривых опустить перпендикуляр на ось абсцисс, то получается число миллилитров HCl соответствующее точке эквивалентности титрования взятого количества NaOH. При кондуктометрическом титровании смеси кислот, например, HCl и CH3COOH, кривая имеет вид трех пересекающихся прямых линий с двумя точками пересечения.
Кондуктометр типа ОК 102-1. Кондуктометр предназначен для определения электропроводности растворов. Прибор снабжен шкалой, отградуированной в единицах сименс (ом-1), позволяющей делать отчеты электропроводности без дополнительной компенсации. Предел измерения кондуктометра – от 0,1 микросименса до 0,5 сименса. Инструкция по работе на кондуктометре ОК 102/1.
1. Включить прибор в сеть, кнопку «ON» поставить в верхнее положение, прогреть прибор в течение 5 мин. 2. Калибровка. Переключатель пределов измерения «Range» поставить в положение 150 мксименс, затем нажать кнопку «Сal». Потенциометром «Calibration» стрелку прибора установить на красную метку. 3. Измерения. Рабочий раствор залить в ячейку и погрузить в него электроды. Следить за тем, чтобы электроды полностью покрывались жидкостью. Переключатель пределов измерения поставить в положение 500 мксименс; если показание мало, увеличить чувствительность прибора. Из полученных значений электропроводности строят график зависимости c от количества прибавляемого раствора щелочи. По графику находят эквивалентную точку и определяют концентрацию раствора, взятого для исследования. Затем выдается контрольный раствор, концентрацию которого необходимо определить. Результаты измерений и расчетов сводятся в таблицу 6.1. Таблица 6.1.
Контрольные вопросы. 1. Произведение растворимости. 2. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. 3. Буферные системы. Состав буферных систем. 4. рН и рОН буферных систем. 5. Влияние разбавления на рН буферных систем. 6. Буферная емкость. 7. Сущность титриметрического анализа. Титр, титрованный раствор, титрант, титрование. Требования к реакциям, применяемым в титриметрии. 8. Основные приемы титрования: прямой, обратный (титрование по остатку), косвенный (титрование по замещению). 9. Потенциометрическое титрование. Кривые титрования. Изменение величины рН при нейтрализации 0,1М раствора кислоты 0,1М раствором щелочи. 10. Кондуктометрическое титрование. Кривые титрования сильных и слабых электролитов.
ЛИТЕРАТУРА 1. Б.В. Ахметов. Задачи и упражнения по физической и коллоидной химии, Ленинград, «Химия», 1989. 2. К.С. Понамарева. Сборник задач по физической химии, Москва, «Металлургиздат», 1962. 3. И.А. Маколкин, Б.А. Шмелев. Сборник примеров и задач по физической и коллоидной химии, Росвузиздат, 1963. 4. В.А. Киреев. Краткий курс физической химии, Москва, «Химия», 1978. 5. С.С. Воюцкий. Курс коллоидной химии, Москва, «Химия», 1975.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 1084; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.1.58 (0.009 с.) |

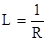
 ) и площади поперечного сечения (S):
) и площади поперечного сечения (S): (Ом)
(Ом) (Ом-1) (1)
(Ом-1) (1) называется удельной электропроводностью проводника. Ее можно представить как электропроводность 1 см3 материала проводника, имеющего площадь поперечного сечения 1 см2. Размерность величины
называется удельной электропроводностью проводника. Ее можно представить как электропроводность 1 см3 материала проводника, имеющего площадь поперечного сечения 1 см2. Размерность величины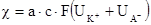 ,
, и
и  - абсолютные скорости перемещения ионов.
- абсолютные скорости перемещения ионов. . Соединив точки, получают две кривые, пересекающиеся в
. Соединив точки, получают две кривые, пересекающиеся в



