
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Приготовление буферных растворов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ЛАБОРАТОРНАЯ РАБОТА №3
Определение рН воды. Теоретическая часть. Как известно, у химически чистой воды показатель рН равен 7. При этом концентрация ионов водорода (Н+) и концентрация ионов гидроксида (ОН-) одинаковы. Это можно объяснить диссоциацией воды, протекающей достаточно слабо: 2Н2О Û Н3О+ + ОН-, или Н2О Û Н+ + ОН- Константа диссоциации воды равна
Поскольку [Н2О] = 55,55 моль/дм3. Кдис × [Н2О] = [Н+]× [ОН-] = 10-14, при 250С. Произведение концентрации ионов Н+ и ОН- называется ионным произведением воды или константой воды КW: КW = [Н+]× [ОН-] = 10-14 г/дм3, откуда [Н+] = [ОН-] = 10-7 г/л, рН = - lg [Н+], Изменение рН на единицу в сторону уменьшения или увеличения свидетельствует об уменьшении или увеличении в 10 раз концентрации водородных ионов. Для питьевой воды рН не должен выходить за пределы 6,0-9,0 единиц рН. Изменение рН воды влечет за собой химическую и биологическую перестройку в водной экосистеме, особенно в относительно замкнутой, какой является пруд или небольшое озеро. В пресноводных озерах и ручьях имеет, как правило, нейтральную или слабокислую реакцию (рН = 6-7), к которой адаптированы все организмы, населяющие эти водоемы. При подкислении водоемов их обитатели быстро вымирают как из-за прямого воздействия, так и вследствие невозможности размножения, поскольку в первую очередь погибает икра и рыбная молодь. Подкисление воды происходит, прежде всего, вследствие кислотных осадков. Оно опасно не только гибелью обитателей водоемов. При низких значениях рН в воде начинают растворяться находящиеся в связанном виде соли тяжелых металлов. Они воздействуют не только на рыб и растения, но и на животных, поедающих рыб или пьющих воду. Если водоем является источником питьевой воды, то тяжелые металлы могут явиться источником серьезных заболеваний и для людей. Кислотность воды обуславливается присутствием следующих веществ: 1. Сильные кислоты, полностью диссоциирующие в разбавленных растворах с образованием ионов водорода. (Хлористоводородная кислота, азотная кислота и т.п.). 2. Слабые кислоты (уксусная кислота, сернистая кислота, угольная кислота, сероводород и т.п.). 3. Катионы слабых оснований: ионы аммония, железа, алюминия, органических оснований и т.п. Соединения, содержащие эти катионы, гидролизуются с образованием ионов водорода. Щелочность воды обуславливается содержанием следующих соединений: 1. Сильные основания, полностью диссоциирующие в разбавленных растворах с образованием гидроксид-ионов (гидроксиды кальция и натрия). 2. Слабые основания (аммиак, анилин, пиридин и т.п.). 3. Анионы слабых кислот (HCO-3, CO2-3, H2PO2-4, HPO2-4, HSO-3, SO2-3, HS-, S2- и т.п.). Эти анионы гидролизуются с образованием гидроксид-ионов. Значения рН можно определить с помощью универсального индикатора, более точное значение рН определяют электрохимическими методами с помощью приборов, называемых иономерами или рН-метрами, в основу работы которых положен потенциометрический метод анализа, основанный на измерении электродвижущей силы (ЭДС) гальванического элемента, составленного из стеклянного индикаторного электрода и серебряного электрода сравнения (вспомогательный электрод).
Классификация электродов. В зависимости от природы электродной реакции различают электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые другие виды электродов. К электродам первого рода относятся электроды типа: а) Мn+/ M (М-металл; Мn+ - потенциал, определяющий катион того же металла); б) Men- / Me (Me – металлоид, Men- - потенциал, определяющий анион того же металлоида). Электродные реакции для электродов I рода записываются так: Mn+ + ne «M Me + ne «Men- Учитывая, что активность чистых твердых M и Me при заданной температуре постоянна и принята условно равной единице, для электродного потенциала электрода первого рода получим уравнение:
или:
Электроды второго рода представляют собой полуэлементы, состоящие из металла М, покрытого слоем его труднорастворимого соединения МА и погруженного, а раствор другого хорошо растворимого соединения, содержащий то же анион Аn- , что и труднорастворимое соединение металла, являющегося электродом. Примером может служить серебряный электрод в растворе, содержащем хлористый калий и находящемся в равновесии с твердым хлористым серебром. Такой электрод можно представить так: Aq / AqCl,Cl- А его потенциал вычислить по формуле:
Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Газовые электроды представляют собой полуэлементы, состоящие из металлического (химически инертного) проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Металл в газовых электродах не только создает электронно-проводящий электрический контакт между газом и раствором его ионов, но и ускоряет медленно устанавливающееся электродное равновесие. Чаще всего таким металлом является платина, покрытая платиновой чернью. Простейшим из газовых электродов является водородный электрод, которому отвечает электродная реакция: 2Н+ + 2е ® Н2 Уравнение для электродного потенциала водородного электрода запишется так:
Окислительно-восстановительные электроды – это системы, состоящие из инертного металла (Pt, Au и др.), обменивающегося электронами с участниками окислительно-восстановительной реакции, находящимися в одной и той же жидкой фазе. Различают простые и сложные редокси-электроды. В случае простых редокси-электродов, электродная реакция сводится к перемене валентности без изменения их состава, например: Fe3+ + е «Fe2+ Для потенциала редокси-электрода получим выражение:
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава.
Наибольшее распространение получили водородный, хингидронный и стеклянный электроды.
а) Определение рН раствора с водородным электродом. Устройство водородного электрода схематично изображено на рисунке. Главной его частью является платиновая пластинка, впаянная в стеклянную трубку. Перед опытом сосуд заполняют раствором с таким расчетом, чтобы приблизительно половина Pt-го электрода находилась в газовой фазе. Через раствор в течение 15-20 минут пропускают ток водорода со скоростью 1-2 пузырька в 2-3 секунды. Водород получают в аппарате Киппа и предварительно очищают от примеси кислорода пропусканием через промывные склянки со щелочным раствором пирогаллола и водой. Для измерения рН раствора обычно собирают цепь: - в которой положительным полюсом служит электрод сравнения. Электродвижущая сила этой цепи измеряется компенсационным методом с использованием компаратора Р 3003. Обозначив ЭДС этой цепи через Е1 получим:
откуда:
б) Хингидронный электрод и определение рН раствора. Хингидрон представляет собой эквимолекулярное соединение хинона и гидрохинона. В водных растворах он частично распадается по уравнению: С6Н4О2 С6Н4(ОН)2 «С6Н4О2 С6Н4(ОН)2 Гидрохинон – слабая кислота, он в незначительной степени диссоциирует на ионы: С6Н4(ОН)2 «С6Н4О2-2 +2Н+ Суммарная реакция, протекающая на электроде, выражается уравнением: С6Н4(ОН)2 «С6Н4О2 +2Н+ + 2 е Хингидронный электрод относится к группе окислительно-восстановительных электродов и потенциал его при 180 может быть выражен уравнением:
для кислых растворов: аХ.Г.=аГ.Х., поэтому
Нормальный электродный потенциал хингидронного электрода, при 180С равный 0,704 В, имеет довольно большой температурный коэффициент. Формула зависимости его от температуры между 0 и 370 имеет вид: Хингидронный электрод получают, помещая гладкий платиновый электрод в исследуемый раствор, в который насыпают небольшое количество порошка хингидрона. Составляют цепь
в которой хингидронный электрод является положительным. ЭДС элемента: откуда:
в) Измерение рН стеклянным электродом. В лабораторной практике широкое применение находит стеклянный электрод. Он представляет собой тонкостенный стеклянный шарик диаметром 1-1,5 см, заполненный стандартным раствором, в который помещен чаще всего хлорсеребряный электрод. Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. ЭДС цепи – Ag / AgCl, HCl / стекло/раствор/KCl, Hg2Cl2 / Hg+ выражается уравнением:
где j0 – нормальный потенциал стеклянного электрода, зависящий от сорта стекла, состава раствора, наполняющего шарик, температуры; m – константа, несколько меньше теоретического значения В связи с тем, что j0ст и m являются неизвестными, стеклянный электрод перед определением рН исследуемого раствора должен быть предварительно прокалиброван. Для калибрования стеклянного электрода необходимо иметь минимум три буферные смеси с различными рН.
Экспериментальная часть. Перечень оборудования и реактивов: универсальная индикаторная бумага рН-метр-милливольтметр рН-150 М, термометр ртутный ТЛ-5 2-52, буферные растворы, исследуемая вода, дистиллированная вода, фильтровальная бумага. 1. Определить рН исследуемой воды с помощью универсального индикатора, для чего капните исследуемой воды на кусочек универсальной индикаторной бумаги и сравните полученный цвет воды с цветной шкалой рН. 2. Определить рН с помощью рН-метра-милливольтметра (рН-150 М. Описание и принцип работы прибора. рН-метр-милливольтметр рН-150 М (в дальнейшем рН-метр) предназначен для измерения активности ионов водорода (рН), окислительно-восстановительных потенциалов (Еh) и температуры водных растворов. Измерение рН, Еh и температуры осуществляется в цифровой форме с помощью измерительного преобразователя (в дальнейшем-преобразователя) и набора электродов. рН-метр является прибором с сетевым и автономным питанием и может быть применен в лабораториях предприятий и научно-исследовательских учреждений различных отраслей промышленности, а также в области охраны окружающей природной среды. Преобразователь соответствует требованиям группы 3 ГОСТ 22261. Электродная система при погружении в контролируемый раствор развивает ЭДС, линейно зависящую от активности ионов и температуры раствора. Контакт вспомогательного электрода с контролируемым раствором осуществляется с помощью электрического ключа, обеспечивающего истечение насыщенного раствора KCl в контролируемый раствор. Раствор хлористого калия непрерывно просачивается через электрический ключ, предотвращая проникновение из контролируемого раствора в систему вспомогательного электрода посторонних ионов, которые могли бы изменить величину потенциала электрода. ЭДС электродной системы преобразуется и считывается с индикатора рН-метра.
Конструкция прибора. РН-метр представляет собой комплект прибора, включающий преобразователь, блок сетевого питания и набор электродов. Преобразователь (рис.10.) выполнен в пластмассовом корпусе. На лицевой панели расположены органы управления, настройки, цифровой жидкокристаллический индикатор 2. Гнездо 5 для подключения электродной системы, вилка 8 для подключения термокомпенсатора и разъем 14 для подключения блока сетевого питания расположены с торца преобразователя в верхней его части.
1- лицевая панель; 2- индикатор; 3- резистор установки температуры раствора при ручной термокомпенсации; 4- переменный резистор для настройки по буферному раствору; 5- гнездо для подключения электродной системы; 6- кнопка переключения режимов измерения; 7-кнопка включения питания; 8- вилка для подключения термокомпенсатора; 9- корпус; 10- резистор для установки значения координаты рН; 11- резистор для регулировки крутизны электродной системы; 12- резисторы для настройки начала и конца диапазона измерения температуры; 13- крышка отсека для размещения автономного источника питания; 14- разъем подключения блока сетевого питания. Перед началом измерения рН новый стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе HCl или в дистиллированной воде. Вспомогательный электрод (электрод сравнения) изнутри промывают дистиллированной водой, сдвинув вниз резиновое кольцо с отверстия и залить насыщенный при 200 раствор хлористого калия. (В процессе измерения кольцо должно быть открыто). Отрегулировать держатель так, чтобы электроды при погружении в раствор не доходили до дна стакана 4-6 мм. 1. Произвести настройку прибора по буферным растворам, имеющими заданное значение рН. 1.1. Поместить электроды в стаканчик с буферным раствором с рН=4,002. 1.2. Измерить температуру буферного раствора с помощью стеклянного термометра и установить это значение температуры на индикаторе для чего необходимо нажимать кнопку «режим» до установления единицы измерения «С0» и вращая ручку «ручн. тем.» установить на индикаторе необходимое значение температуры. Измерить рН буферного раствора с температурой t. 1.3. Погрузить электроды в 1-ый буферный раствор с рН=4,002 (при t = 200С). 1.4. Нажимая кнопку «режим», установить единицу измерения «МВ» и снять показания рН по индикатору. В случае разницы показаний с заданным значением рН произвести корректировку, вращая ось резистора «Буфер» установить на индикаторе заданное значение рН=4,002. 1.5. Промыть электрод дистиллированной водой, осушить фильтровальной бумагой и погрузить во 2-ой буферный раствор с рН=9,22. 1.6. Вращая ось резистора «S» на боковой стенке преобразователя, установить на индикаторе значение, равное заданному значению рН 2-го буферного раствора. 2. Определение рН исследуемой воды. 2.1. исследуемую воду налить в стаканчик и погрузить в него электроды, предварительно промыв их дистиллированной водой и осушив фильтровальной бумагой. 2.2. Снять показания рН по индикатору в «режиме» «МВ». Повторить измерение рН этого же раствора. За окончательный результат взять среднеарифметическое значение. По окончании работы выключают прибор. Электроды промывают дистиллированной водой и оставляют их погруженными в дистиллированную воду.
ЛАБОРАТОРНАЯ РАБОТА № 4
ЛАБОРАТОРНАЯ РАБОТА №5 ЛАБОРАТОРНАЯ РАБОТА №6 Экспериментальная часть Для выполнения кондуктометрического титрования раствора едкого натра соляной кислотой в сосуд отмеривают (пипеткой или бюреткой) определенное количество титруемой щелочи и доливают воды настолько, чтобы электрод был полностью погружен в раствор. Затем, пустив в ход мешалку, передвигают подвижной контакт к середине и вводят в реостат R такое сопротивление, которое дало бы минимум тока. Более точно минимум тока достигается передвижением контакта по мостику. Деление мостика, соответствующее минимуму тока, записывают. Затем приливают из бюретки 1 мл кислоты. Тот час же замечается усиление тока, и тогда опять с помощью подвижного контакта добиваются нового минимума тока и вновь записывают показания мостика. Так поступают и дальше. Сперва после каждой добавленной порции кислоты для достижения минимума тока приходится передвигать подвижной контакт все время в одну сторону, например, вправо, затем около точки эквивалентности после прибавки кислоты направление передвижения контакта приходится менять в обратную сторону. После изменения направления передвижения контакта достаточно для проверки прибавить только несколько миллилитров кислоты и опыт можно закончить. При опыте необходимо, чтобы электроды были хорошо укреплены и температура, по возможности, держалась бы постоянной. Результаты измерений затем наносят на график. При этом на ось абсцисс наносят миллилитры HCl, а на ось ординат – электропроводность раствора
Рис. 11. Кривая кондуктометрического Рис. 12. Кривые кондуктометрического титрования едкого натра соляной титрования соляной и уксусной кислотой. кислот в смеси. 1- 0,02 н HCl + 0,02 н CH3COOH титруется 0,6 н NaOH; 2- 0,1 н HCl + 0,1 н CH3COOH титруется 1,0 н NaOH.
одной точке. Если из точки пересечения этих кривых опустить перпендикуляр на ось абсцисс, то получается число миллилитров HCl соответствующее точке эквивалентности титрования взятого количества NaOH. При кондуктометрическом титровании смеси кислот, например, HCl и CH3COOH, кривая имеет вид трех пересекающихся прямых линий с двумя точками пересечения.
Кондуктометр типа ОК 102-1. Кондуктометр предназначен для определения электропроводности растворов. Прибор снабжен шкалой, отградуированной в единицах сименс (ом-1), позволяющей делать отчеты электропроводности без дополнительной компенсации. Предел измерения кондуктометра – от 0,1 микросименса до 0,5 сименса. Инструкция по работе на кондуктометре ОК 102/1.
1. Включить прибор в сеть, кнопку «ON» поставить в верхнее положение, прогреть прибор в течение 5 мин. 2. Калибровка. Переключатель пределов измерения «Range» поставить в положение 150 мксименс, затем нажать кнопку «Сal». Потенциометром «Calibration» стрелку прибора установить на красную метку. 3. Измерения. Рабочий раствор залить в ячейку и погрузить в него электроды. Следить за тем, чтобы электроды полностью покрывались жидкостью. Переключатель пределов измерения поставить в положение 500 мксименс; если показание мало, увеличить чувствительность прибора. Из полученных значений электропроводности строят график зависимости c от количества прибавляемого раствора щелочи. По графику находят эквивалентную точку и определяют концентрацию раствора, взятого для исследования. Затем выдается контрольный раствор, концентрацию которого необходимо определить. Результаты измерений и расчетов сводятся в таблицу 6.1. Таблица 6.1.
Контрольные вопросы. 1. Произведение растворимости. 2. Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели. 3. Буферные системы. Состав буферных систем. 4. рН и рОН буферных систем. 5. Влияние разбавления на рН буферных систем. 6. Буферная емкость. 7. Сущность титриметрического анализа. Титр, титрованный раствор, титрант, титрование. Требования к реакциям, применяемым в титриметрии. 8. Основные приемы титрования: прямой, обратный (титрование по остатку), косвенный (титрование по замещению). 9. Потенциометрическое титрование. Кривые титрования. Изменение величины рН при нейтрализации 0,1М раствора кислоты 0,1М раствором щелочи. 10. Кондуктометрическое титрование. Кривые титрования сильных и слабых электролитов.
ЛИТЕРАТУРА 1. Б.В. Ахметов. Задачи и упражнения по физической и коллоидной химии, Ленинград, «Химия», 1989. 2. К.С. Понамарева. Сборник задач по физической химии, Москва, «Металлургиздат», 1962. 3. И.А. Маколкин, Б.А. Шмелев. Сборник примеров и задач по физической и коллоидной химии, Росвузиздат, 1963. 4. В.А. Киреев. Краткий курс физической химии, Москва, «Химия», 1978. 5. С.С. Воюцкий. Курс коллоидной химии, Москва, «Химия», 1975.
ЛАБОРАТОРНАЯ РАБОТА №3
Определение рН воды. Теоретическая часть. Как известно, у химически чистой воды показатель рН равен 7. При этом концентрация ионов водорода (Н+) и концентрация ионов гидроксида (ОН-) одинаковы. Это можно объяснить диссоциацией воды, протекающей достаточно слабо: 2Н2О Û Н3О+ + ОН-, или Н2О Û Н+ + ОН- Константа диссоциации воды равна
Поскольку [Н2О] = 55,55 моль/дм3. Кдис × [Н2О] = [Н+]× [ОН-] = 10-14, при 250С. Произведение концентрации ионов Н+ и ОН- называется ионным произведением воды или константой воды КW: КW = [Н+]× [ОН-] = 10-14 г/дм3, откуда [Н+] = [ОН-] = 10-7 г/л, рН = - lg [Н+], Изменение рН на единицу в сторону уменьшения или увеличения свидетельствует об уменьшении или увеличении в 10 раз концентрации водородных ионов. Для питьевой воды рН не должен выходить за пределы 6,0-9,0 единиц рН. Изменение рН воды влечет за собой химическую и биологическую перестройку в водной экосистеме, особенно в относительно замкнутой, какой является пруд или небольшое озеро. В пресноводных озерах и ручьях имеет, как правило, нейтральную или слабокислую реакцию (рН = 6-7), к которой адаптированы все организмы, населяющие эти водоемы. При подкислении водоемов их обитатели быстро вымирают как из-за прямого воздействия, так и вследствие невозможности размножения, поскольку в первую очередь погибает икра и рыбная молодь. Подкисление воды происходит, прежде всего, вследствие кислотных осадков. Оно опасно не только гибелью обитателей водоемов. При низких значениях рН в воде начинают растворяться находящиеся в связанном виде соли тяжелых металлов. Они воздействуют не только на рыб и растения, но и на животных, поедающих рыб или пьющих воду. Если водоем является источником питьевой воды, то тяжелые металлы могут явиться источником серьезных заболеваний и для людей. Кислотность воды обуславливается присутствием следующих веществ: 1. Сильные кислоты, полностью диссоциирующие в разбавленных растворах с образованием ионов водорода. (Хлористоводородная кислота, азотная кислота и т.п.). 2. Слабые кислоты (уксусная кислота, сернистая кислота, угольная кислота, сероводород и т.п.). 3. Катионы слабых оснований: ионы аммония, железа, алюминия, органических оснований и т.п. Соединения, содержащие эти катионы, гидролизуются с образованием ионов водорода. Щелочность воды обуславливается содержанием следующих соединений: 1. Сильные основания, полностью диссоциирующие в разбавленных растворах с образованием гидроксид-ионов (гидроксиды кальция и натрия). 2. Слабые основания (аммиак, анилин, пиридин и т.п.). 3. Анионы слабых кислот (HCO-3, CO2-3, H2PO2-4, HPO2-4, HSO-3, SO2-3, HS-, S2- и т.п.). Эти анионы гидролизуются с образованием гидроксид-ионов. Значения рН можно определить с помощью универсального индикатора, более точное значение рН определяют электрохимическими методами с помощью приборов, называемых иономерами или рН-метрами, в основу работы которых положен потенциометрический метод анализа, основанный на измерении электродвижущей силы (ЭДС) гальванического элемента, составленного из стеклянного индикаторного электрода и серебряного электрода сравнения (вспомогательный электрод).
Классификация электродов. В зависимости от природы электродной реакции различают электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые другие виды электродов. К электродам первого рода относятся электроды типа: а) Мn+/ M (М-металл; Мn+ - потенциал, определяющий катион того же металла); б) Men- / Me (Me – металлоид, Men- - потенциал, определяющий анион того же металлоида). Электродные реакции для электродов I рода записываются так: Mn+ + ne «M Me + ne «Men- Учитывая, что активность чистых твердых M и Me при заданной температуре постоянна и принята условно равной единице, для электродного потенциала электрода первого рода получим уравнение:
или:
Электроды второго рода представляют собой полуэлементы, состоящие из металла М, покрытого слоем его труднорастворимого соединения МА и погруженного, а раствор другого хорошо растворимого соединения, содержащий то же анион Аn- , что и труднорастворимое соединение металла, являющегося электродом. Примером может служить серебряный электрод в растворе, содержащем хлористый калий и находящемся в равновесии с твердым хлористым серебром. Такой электрод можно представить так: Aq / AqCl,Cl- А его потенциал вычислить по формуле:
Величины потенциалов электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяются в качестве стандартных полуэлементов или электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Газовые электроды представляют собой полуэлементы, состоящие из металлического (химически инертного) проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Металл в газовых электродах не только создает электронно-проводящий электрический контакт между газом и раствором его ионов, но и ускоряет медленно устанавливающееся электродное равновесие. Чаще всего таким металлом является платина, покрытая платиновой чернью. Простейшим из газовых электродов является водородный электрод, которому отвечает электродная реакция: 2Н+ + 2е ® Н2 Уравнение для электродного потенциала водородного электрода запишется так:
Окислительно-восстановительные электроды – это системы, состоящие из инертного металла (Pt, Au и др.), обменивающегося электронами с участниками окислительно-восстановительной реакции, находящимися в одной и той же жидкой фазе. Различают простые и сложные редокси-электроды. В случае простых редокси-электродов, электродная реакция сводится к перемене валентности без изменения их состава, например: Fe3+ + е «Fe2+ Для потенциала редокси-электрода получим выражение:
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава.
Наибольшее распространение получили водородный, хингидронный и стеклянный электроды.
а) Определение рН раствора с водородным электродом. Устройство водородного электрода схематично изображено на рисунке. Главной его частью является платиновая пластинка, впаянная в стеклянную трубку. Перед опытом сосуд заполняют раствором с таким расчетом, чтобы приблизительно половина Pt-го электрода находилась в газовой фазе. Через раствор в течение 15-20 минут пропускают ток водорода со скоростью 1-2 пузырька в 2-3 секунды. Водород получают в аппарате Киппа и предварительно очищают от примеси кислорода пропусканием через промывные склянки со щелочным раствором пирогаллола и водой. Для измерения рН раствора обычно собирают цепь: - в которой положительным полюсом служит электрод сравнения. Электродвижущая сила этой цепи измеряется компенсационным методом с использованием компаратора Р 3003. Обозначив ЭДС этой цепи через Е1 получим:
откуда:
б) Хингидронный электрод и определение рН раствора. Хингидрон представляет собой эквимолекулярное соединение хинона и гидрохинона. В водных растворах он частично распадается по уравнению: С6Н4О2 С6Н4(ОН)2 «С6Н4О2 С6Н4(ОН)2 Гидрохинон – слабая кислота, он в незначительной степени диссоциирует на ионы: С6Н4(ОН)2 «С6Н4О2-2 +2Н+ Суммарная реакция, протекающая на электроде, выражается уравнением: С6Н4(ОН)2 «С6Н4О2 +2Н+ + 2 е Хингидронный электрод относится к группе окислительно-восстановительных электродов и потенциал его при 180 может быть выражен уравнением:
для кислых растворов: аХ.Г.=аГ.Х., поэтому
Нормальный электродный потенциал хингидронного электрода, при 180С равный 0,704 В, имеет довольно большой температурный коэффициент. Формула зависимости его от температуры между 0 и 370 имеет вид: Хингидронный электрод получают, помещая гладкий платиновый электрод в исследуемый раствор, в который насыпают небольшое количество порошка хингидрона. Составляют цепь
в которой хингидронный электрод является положительным. ЭДС элемента: откуда:
в) Измерение рН стеклянным электродом. В лабораторной практике широкое применение находит стеклянный электрод. Он представляет собой тонкостенный стеклянный шарик диаметром 1-1,5 см, заполненный стандартным раствором, в который помещен чаще всего хлорсеребряный электрод. Для измерения рН стеклянный электрод погружают в исследуемый раствор в паре с электродом сравнения. ЭДС цепи – Ag / AgCl, HCl / стекло/раствор/KCl, Hg2Cl2 / Hg+ выражается уравнением:
где j0 – нормальный потенциал стеклянного электрода, зависящий от сорта стекла, состава раствора, наполняющего шарик, температуры; m – константа, несколько меньше теоретического значения В связи с тем, что j0ст и m являются неизвестными, стеклянный электрод перед определением рН исследуемого раствора должен быть предварительно прокалиброван. Для калибрования стеклянного электрода необходимо иметь минимум три буферные смеси с различными рН.
Экспериментальная часть. Перечень оборудования и реактивов: универсальная индикаторная бумага рН-метр-милливольтметр рН-150 М, термометр ртутный ТЛ-5 2-52, буферные растворы, исследуемая вода, дистиллированная вода, фильтровальная бумага. 1. Определить рН исследуемой воды с помощью универсального индикатора, для чего капните исследуемой воды на кусочек универсальной индикаторной бумаги и сравните полученный цвет воды с цветной шкалой рН. 2. Определить рН с помощью рН-метра-милливольтметра (рН-150 М. Описание и принцип работы прибора. рН-метр-милливольтметр рН-150 М (в дальнейшем рН-метр) предназначен для измерения активности ионов водорода (рН), окислительно-восстановительных потенциалов (Еh) и температуры водных растворов. Измерение рН, Еh и температуры осуществляется в цифровой форме с помощью измерительного преобразователя (в дальнейшем-преобразователя) и набора электродов. рН-метр является прибором с сетевым и автономным питанием и может быть применен в лабораториях предприятий и научно-исследовательских учреждений различных отраслей промышленности, а также в области охраны окружающей природной среды. Преобразователь соответствует требованиям группы 3 ГОСТ 22261. Электродная система при погружении в контролируемый раствор развивает ЭДС, линейно зависящую от активности ионов и температуры раствора. Контакт вспомогательного электрода с контролируемым раствором осуществляется с помощью электрического ключа, обеспечивающего истечение насыщенного раствора KCl в контролируемый раствор. Раствор хлористого калия непрерывно просачивается через электрический ключ, предотвращая проникновение из контролируемого раствора в систему вспомогательного электрода посторонних ионов, которые могли бы изменить величину потенциала электрода. ЭДС электродной системы преобразуется и считывается с индикатора рН-метра.
Конструкция прибора. РН-метр представляет собой комплект прибора, включающий преобразователь, блок сетевого питания и набор электродов. Преобразователь (рис.10.) выполнен в пластмассовом корпусе. На лицевой панели расположены органы управления, настройки, цифровой жидкокристаллический индикатор 2. Гнездо 5 для подключения электродной системы, вилка 8 для подключения термокомпенсатора и разъем 14 для подключения блока сетевого питания расположены с торца преобразователя в верхней его части.
1- лицевая панель; 2- индикатор; 3- резистор установки температуры раствора при ручной термокомпенсации; 4- переменный резистор для настройки по буферному раствору; 5- гнездо для подключения электродной системы; 6- кнопка переключения режимов измерения; 7-кнопка включения питания; 8- вилка для подключения термокомпенсатора; 9- корпус; 10- резистор для установки значения координаты рН; 11- резистор для регулировки крутизны электродной системы; 12- резисторы для настройки начала и конца диапазона измерения температуры; 13- крышка отсека для размещения автономного источника питания; 14- разъем подключения блока сетевого питания. Перед началом измерения рН новый стеклянный электрод должен быть выдержан не менее суток в 0,1 М растворе HCl или в дистиллиров
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-16; просмотров: 613; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.104.175 (0.016 с.) |






 т.к.
т.к. 

 Рис. 9. Водородный электрод
Рис. 9. Водородный электрод



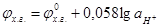





 за счет малого сопротивления потенциометра и наличия утечек тока в цепи.
за счет малого сопротивления потенциометра и наличия утечек тока в цепи.
 . Соединив точки, получают две кривые, пересекающиеся в
. Соединив точки, получают две кривые, пересекающиеся в



