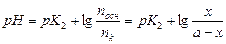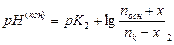Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы приготовления буферных растворов с заданным значением рН.Содержание книги
Поиск на нашем сайте
Существует два способа приготовления буферных растворов: 1) путем смешения водных растворов сопряжённых кислоты и основания. 2) путем частичной нейтрализации слабой кислоты – щёлочью или слабого основания – сильной кислотой. Второй способ широко используется в лабораторной практике при приготовлении буферных смесей с использованием рН – метра, когда нейтрализацию ведут до заданного значения рН, величину которого контролируют по прибору. 1. Приготовить фосфатный буфер объемом Vбуф. с заданным значением рН методом смешения растворов дигидрофосфата и гидрофосфата натрия:
1.1 Определим объемы V к и V 0 исходных растворов сопряжённых кислоты и основания, если известны их концентрации c к(нач) и c осн(нач) . Для расчёта необходимо составить два уравнения, первое из которых очевидно V буф = Vосн + V к (6.4) а второе получим на основе уравнения (6.2). Поскольку количества солей в буферном растворе равно их количеству в соответсвующих объёмах исходных растворов, то nосн (в буферном растворе) = cосн (нач) Ч V осн, nк (в буферном растворе) = cк (нач) Ч V к
Подставляя эти величины в уравнение (6.2), находим второе уравнение связи между искомыми объёмами:
Решая систему из двух уравнений (6.4) и (6.5) или (6.4) и (6.6), находим объёмы растворов V к и V осн, при смешении которых образуется буферный раствор с заданным значением рН. 2) Этот же буферный раствор можно приготовить путём частичной нейтрализации фосфорной кислоты щёлочью, например NaOH. Пусть в растворе фосфорной кислоты объёмом V дм3 и молярной концентрацией c (Н3РО4) моль/дм3 содержится n (Н3РО4) = c (Н3РО4) ЧV = а моль Н3РО4. Гидрофосфатный буферный раствор содержит смесь двух солей Na2HPO4 / NaH2PO4, поэтому расчеты при нейтрализации кислоты проводят в два этапа: перевод а моль фосфорной кислоты в дигидрофосфат – ион (I этап) и далее частичный перевод дигидрофосфат-иона в гидрофосфат-ион до нужного значения рН (II этап) – решение задач на избыток-недостаток:
Необходимое количество щёлочи х для осуществления второго этапа определяют по уравнению (2):
Общее количество NaOH равно n общ.(I+II этапы) = а + х, и если в исходный раствор фосфорной кислоты добавляют кристаллический NaOH, то его масса равна m (NaOH) = =(a + x) Ч M (NaOH); если добавляют раствор щёлочи, то его объём равен:
Расчёт изменения рН при добавлении к гидрофосфатному буферному раствору небольших добавок сильной кислоты или щёлочи, а также при его разбавлении (расчет изменения рН в результате буферного действия). Пусть исходный буферный раствор объёмом V содержит n к моль кислоты и n осн моль сопряжённого основания, тогда в соответствии с уравнением (6.2):
а) добавление сильной кислоты НnX:
и конечные количества компонентов буферной смеси равны: n осн (кон.) = n осн – х; nк(кон.) = nк + х. Величина рН конечного состояния рассчитывается по формуле:
причём происходит небольшой сдвиг в кислую область рН(нач) > рН(кон). б) добавление щёлочи M(OH)n:
и конечные количества компонентов буферной смеси равны: nосн (кон.) = nосн + х; n к(кон.) = n к - х Величина рН конечного состояния рассчитывается по формуле:
причём происходит небольшой сдвиг в щелочную область: рН(нач) < рН(кон). Примечание: nосн и nк относятся к объёму буферного раствора, в который сделаны добавки. в) при разбавлении буферного раствора водой исходные концентрации его компонентов c осн и c к уменьшаются в одинаковое число раз, поэтому их отношение в уравнении (6.1) остаётся неизменным и, следовательно, величина рН сохраняется.
|
|||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 315; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.118.151 (0.007 с.) |