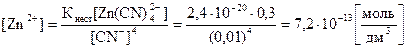Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение жесткости воды (комплексонометрия)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Природная вода рек и озер представляет собой сложную систему, химический состав которой зависит от природы подстилающих грунтов, почв прибрежной зоны, сезонных и погодных условий, хозяйственной деятельности человека. Обычно она содержит в своем составе ионы растворенных солей: катионы Са2+ > Na+ > Mg2+ > K+ и др., анионы Cl– > HCO3– > SO42–и др., а также во взвешенном состоянии коллоидные примеси – простейшие микроорганизмы (планктон), глинистые и кварцевые частицы, частицы гумусовых веществ (высокомолекулярные гуминовые и фульвокислоты). Последние являются продуктами биохимической деструкции остатков растительного и животного происхождения. Вода минеральных источников содержит значительно меньше коллоидных примесей, но в ней в большем количестве присутствуют растворенные соли. Химический состав бутылированной минеральной воды обычно указывают на этикетке. На станциях водоподготовки из природной воды удаляют методом коагуляции коллоидные примеси – эта процедура называется осветлением воды, проводят ее дезинфекцию и подают в водопроводные сети. При этом ионный состав питьевой воды практически не меняется и соответствует природному источнику. Жёсткость воды – это совокупность химических и физических свойств воды, связанных с содержанием в ней растворённых солей щёлочноземельных металлов, главным образом, кальция и магния (так называемых «солей жёсткости»). Вода с большим содержанием солей кальция и магния называется жёсткой, с малым содержанием – мягкой. В жесткой воде плохо развариваются мясо и овощи, она сушит кожу при умывании, вызывает появление осадка (накипи) на стенках домашней посуды, котлов, в трубах. Термин «жёсткая» по отношению к воде исторически сложился из-за свойств тканей после их стирки с использованием мыла на основе солей жирных кислот – ткань, постиранная в жёсткой воде, оказывается более жёсткой на ощупь. Это объясняется тем, что содержащиеся в мыле растворимые натриевые соли жирных карбоновых кислот переходят в жесткой воде в малорастворимые кальциевые и магниевые соли тех же кислот, которые и оседают на поверхности тканей, придавая им жесткость. Жёсткость природных вод может варьировать в довольно широких пределах, и в течение года непостоянна. Увеличивается жёсткость из-за испарения воды, уменьшается в сезон дождей, а также в период таяния снега и льда. Вкус природной питьевой воды, например, воды родников, обусловлен именно присутствием солей жёсткости.
Различают временную (карбонатную) жёсткость, обусловленную гидрокарбонатами кальция и магния Са(НСО3)2; Mg(НСО3)2, и постоянную (некарбонатную) жёсткость, вызванную присутствием других солей этих металлов, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов (CaSO4, CaCl2, MgSO4, MgCl2). Суть устранения жесткости (умягчения) воды заключается в связывании ионов Са2+ и Mg2+ с образованием устойчивых соединений и последующего их удаления. 1. Термоумягчение. Основано на кипячении воды, в результате которого термически нестойкие гидрокарбонаты кальция и магния разлагаются с образованием накипи: Ca(HCO3)2 → CaCO3↓ + CO2 + H2O; Mg(HCO3)2 → Mg(OH)2↓ + 2 CO2. Кипячение устраняет только временную (карбонатную) жёсткость. Находит применение в быту. 2. Реагентное умягчение. Метод основан на добавлении к воде кальцинированной соды Na2CO3 или гашёной извести Ca(OH)2. При этом соли кальция и магния переходят в малорастворимые соединения и выпадают в осадок. Например, добавление гашёной извести приводит к переводу солей кальция в его малорастворимый карбонат: Ca(HCO3)2 + Ca(OH)2 → 2CaCO3↓ + 2H2O; добавление соды переводит соли магния в его малорастворимый гидроксокарбонат: 2 MgCl2 + 3 Na2CO3 + 2 H2O → (MgOH)2CO3↓ + 2 NaHCO3 + 4 NaCl Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4, входящий в состав большинства препаратов бытового и промышленного назначения для умягчения воды: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Осадки малорастворимых веществ легко отделяются механическим фильтрованием. Этот метод оправдан при умягчении относительно небольших объемов воды, поскольку связан с решением ряда специфических проблем – фильтрацией осадка, точной дозировкой реагента. 3. Ионный обмен. Метод основан на использовании синтетических ионообменных смол (ионитов), представляющих собой не растворимые в воде твердые полимеры (R), вдоль цепи которых располагаются ионогенные группировки – остатки кислот или оснований. В первом случае смола называется катионитом, поскольку кислотные остатки, например, сульфогруппы R–SО3Н или карбоксильные группы R–СООН, содержат подвижные катионы Н+, способные к ионному обмену на катионы из раствора. Во втором случае смола называется анионитом, где ионогенными являются аминогруппы:
R–NH2 + H2O → R–NH3OH, которые содержат подвижные анионы ОН–, способные к ионному обмену на анионы из раствора. Синтетические ионообменные смолы выпускаются промышленностью в виде небольших зерен (гранул) диаметром 0,5 – 1 мм, которые перед употреблением вымачивают в воде для набухания. Далее из них формируют ионообменники, через которые пропускают воду. а) Умягчение воды с помощью катионитов. Сначала через катионит R–SО3Н пропускают раствор хлорида натрия, заменяя подвижный катион Н+ смолы на катион Na+ из раствора:
R–SО3Н (смола Н–форма) + NaCl (раствор)→ R–SО3Na (смола Na-форма) + НСl (раствор).
Далее через катионит в Na– форме фильтруют жесткую воду, из которой катионы кальция и магния переходят на смолу, а катионы натрия переходят в воду:
2 R–SО3Na(смола Na-форма) + Са2+(Mg2+) (вода)→[R–SО3]2Ca (Mg)(смола) + 2Na+ (вода).
Отработанный катионит регенерируют с помощью раствора хлорида натрия. б) Обессоливание воды – удаление из нее как катионов, так и анионов растворенных солей. Сначала воду пропускают через катионит в Н– форме, в результате чего все катионы солей переходят на смолу, заменяя в эквивалентном количестве ионы Н+: z R–SО3Н (смола Н–форма) + Katz+ (вода) → [R–SО3]z Kat(смола) + z H+ (вода). После этой процедуры смесь солей заменяется эквивалентной смесью минеральных кислот – хлороводородной, серной, угольной и др. Далее образовавшуюся кислую воду пропускают через анионит в ОН–форме, при этом анионы кислот из воды переходят на смолу, заменяя в эквивалентном количестве гидроксид– ионы ОН–: z R–NH3OH(смола ОН-форма) + Anя– (вода)→ [R–NH3]z An (смола) + z OH– (вода). Переходящие в воду гидроксид – ионы ОН– нейтрализуют ионы Н+: H+ + OH– → Н2О. Использованные смолы регенерируют, пропуская через катионит раствор хлороводородной кислоты, а через анионит – раствор гидроксида натрия. 4. Обратный осмос. Метод основан на продавливании предварительно очищенной от коллоидных примесей воды через полупроницаемые мембраны (как правило, полиамидные) под действием избыточного внешнего давления, в 2 – 3 раза превышающего осмотическое давление исходной воды. Вместе с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9 %, но данный метод достаточно дорог. 5. Дистилляция – этот метод очистки воды, в том числе и от солей жесткости, широко используется в лабораторной практике. Количественной характеристикой жесткости воды (Ж) является суммарное количество миллимолей эквивалентов катионов кальция
где с (…) – молярные концентрации эквивалентов ионов кальция и магния, моль/дм3; 103 – переводной множитель от моль/дм3 к ммоль/дм3; ρ (…) – массовые концентрации ионов кальция и магния, мг/дм3; 20,04 и 12,15 г/моль – молярные массы эквивалентов кальция и магния.
С 1 января 2005 года в России введен ГОСТ жесткости воды – она выражается в градусах жесткости (°Ж). Один градус жесткости °Ж соответствует молярной концентрации эквивалента ионов щелочноземельного металла
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2–10 °Ж) и жёсткую (более 10 °Ж). Санитарная норма для питьевой воды составляет Ж < 7 °Ж.
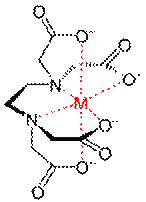
Экспериментальное определение общей жесткости воды проводят методом комплексонометрического титрования, в основе которого лежит реакция комплексообразования между реагентом и катионами кальция и магния, содержащимися в анализируемой воде. Титрантом является раствор динатриевой соли этилендиаминтетрауксусной кислоты (коммерческое название – трилон Б или комплексон III) – краткое обозначение Na2H2γ (рисунок 1). Этот раствор готовят на основе промышленно изготовленного фиксанала и химически активной частицей в стандартном растворе является анион H2γ2–.
Рисунок 1 – Структурная формула трилона Б (слева) и пространственное строение комплексного соединения между катионами кальция и магния и анионом этилендиаминтетрауксусной кислоты (шестидентатный лиганд).
Для установления точки эквивалентности применяют металлоиндикатор эриохром черный Т – это трехосновная слабая органическая кислота, которую условно записывают в виде Н3Ind.
В зависимости от рН среды индикатор образует по-разному окрашенные анионы:
Кроме того, индикатор, в отличие от трилона Б, образует с катионами кальция и магния окрашенные комплексные соединения, но их прочность ниже, чем прочность комплексов с участием трилона Б. Индикатор вносят в исследуемую воду в твердом виде. Суть определения жесткости воды в следующем. Аликвоту исследуемой воды переносят в колбу для титрования, к ней добавляют 5 см3 аммиачного буферного раствора, имеющего рН = 9– 10, для стабилизации кислотности среды и далее на кончике шпателя вносят несколько крупинок твердого индикатора эриохрома черного Т. При данном значении рН индикатор находится в форме HInd2– и дает с частью катионов магния комплекс, придающий раствору винно-красную окраску:
При титровании полученной смеси стандартным раствором трилона Б, сначала он реагирует со свободными ионами кальция и магния: Ca2+ (вода) + H2γ2– → Саγ2– + 2 Н+ Mg2+ (вода) + H2γ2– → Mgγ2– + 2 Н+, а на последнем этапе происходит разрушение менее устойчивого комплекса MgInd– с образованием более устойчивого комплекса Mgγ2–, причем полное исчезновение первого в точке эквивалентности сопровождается резким переходом окраски от винно-красной в синюю:
MgInd– + H2γ2– → Mgγ2– + HInd2– + H+. винно-красный синий Титриметрическую реакцию комплексообразования трилона Б с катионами кальция и магния можно рассматривать как ионообменную реакцию, которая сопровождается образованием двух ионов водорода, поэтому числа эквивалентности реагентов равны 2 и закон эквивалентов имеет вид:
откуда
где Vал и Vт – аликвота исследуемой воды и объем титранта, см3;
Экспериментальное определение временной жесткости, обусловленной присутствием в воде гидрокарбонатов кальция Са(НСО3)2 и магния Mg(НСО3)2, связано с определением молярной концентрации гидрокарбонат- ионов НСО3–, поскольку каждому эквиваленту кальция НСО3– (вода) + НCl (титрант) → Н2СО3 + Cl–. По закону эквивалентов
откуда
Последний результат позволяет рассчитать постоянную жесткость, связанную с присутствием в воде хлоридов, сульфатов, нитратов кальция и магния и др.: Жпостоянная = Жобщая – Жвременная (9.4) ОБУЧАЮЩИЕ ЗАДАЧИ 1. Выбрать наиболее прочное комплексное соединение из соединений Fe2+ с биолигандами: глицерином (1), гистидином (2), лизином (3). Решение: прочность комплекса характеризуется Кнест: чем меньше Кнест, тем комплекс более прочный. Из справочника: Кнест (1)=1,58·10-8 Кнест (2)=5,01·10-10 Кнест (3)=3,16·10-5 Ответ: наиболее прочное комплексное соединение Fe2+ c гистидином, т.к. Кнест (2) < Кнест (1) < Кнест (3).
2. Вычислить концентрацию ионов Аg+ в 0,1 М растворе [Ag(NH3)2]+, если Кнест=1∙10-8. Решение: если обозначить концентрацию ионов Ag+ через х, то раствор будет характеризоваться следующими равновесными концентрациями (моль/дм3):
Так как диссоциация комплексного иона невелика, то разность 0,1-х можно принять равной 0,1. Тогда Кнест = Отсюда 4х3=10-9, Ответ: [Ag+] в растворе аммиака серебра составляет 6,3 ∙ 10-4 моль/дм3.
3. Вычислить концентрацию ионов Zn2+ в растворе Na2[Zn(CN)4] с концентрацией 0,3 моль/дм3 при избытке цианид-ионов, равном 0,01 моль/дм3. Решение: вторичная диссоциация комплексного иона протекает по уравнению:
[Zn(CN)4]2- Û Zn2+ + 4CN- Кнест =
Ответ: [Zn2+] в растворе тетрацианоцинката (II) натрия составляет 7,2·10-3 моль/дм3.
4. Возможно ли разрушение комплекса [Ag(NH3)2]+, концентрация которого в растворе составляет 0,1 моль/дм3, добавлением раствора КCl равного объема и равной концентрации. Увеличением объема пренебречь. Решение: при добавлении KСl в растворе возможны два равновесных процесса:
Условием выпадения осадка АgCl и, следовательно, разрушения комплексного иона является соблюдение неравенства: ПИ > ПР, где ПИ = с(Ag+) ∙ c(Cl-); с(Ag+) = 6,3 ∙ 10-4 моль/дм3 см. предыдущую задачу, с(Cl-) = с(КCl) = 0,1 моль/дм3, тогда ПИ = 6,3∙10-4∙0,1= 6,3 ∙ 10-5; ПИ > ПР – осадок выпадает, Комплекс в отсутствие избытка NH3 ионами Cl- разрушается.
Лабораторная работа №6
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 1475; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.142.90 (0.015 с.) |

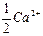 и катионов магния
и катионов магния  , содержащихся в одном литре воды, ммоль/дм3:
, содержащихся в одном литре воды, ммоль/дм3: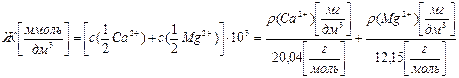 (9.1)
(9.1)
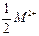 равной
равной  .
.
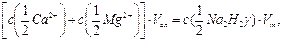
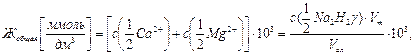 (9.2)
(9.2)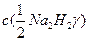 – молярная концентрация эквивалента трилона Б, моль/дм3.
– молярная концентрация эквивалента трилона Б, моль/дм3.
 (9.3)
(9.3)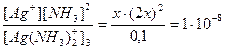 ,
,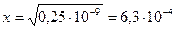 .
.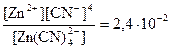 (справочная величина)
(справочная величина)